Настольная книга учителя по химии 9 класс - поурочные разработки
Общие химические свойства металлов - Металлы
Цели урока. Обобщить знания учащихся, полученные ранее, при рассмотрении общих химических свойств металлов. Повторить особенности протекания реакций металлов с растворами электролитов. Развивать логические операции мышления при обобщении знаний и конкретизации общих свойств металлов для отдельных представителей этого класса простых веществ.
Оборудование и реактивы. Li, Na, Са, Аl (фольга и в порошке), Zn (в порошке), Сu, Fe (тонкая проволока, игла, скрепки и порошок); Mg (порошок и лента); I2 (крист.), S, Sb (крист.); Вr2(ж.); КМnO4 (крист.) и НСl (для получения хлора и кислорода); CuSO4 (р-р); СuО; фенолфталеин; термит; пробирки, колбы, прибор для получения газов, спиртовка, ложечки для сжигания веществ, воронки, вата, фильтровальная бумага, кодоскоп, чашечки Петри, стеклянные трубки (широкие), стаканы, кристаллизаторы, лучинка, фарфоровые чашечки, пипетки, железные и фарфоровые тигли.
I. Систематизация и обобщение знаний об общих свойствах металлов
Учитель просит ребят назвать одним словом общие химические свойства металлов на основании строения их атомов. Учащиеся без труда отвечают — «восстановители», так как атомы металлов только отдают свои электроны, образуя при этом положительные ионы — катионы, а потому они проявляют только восстановительные свойства. А какие вещества — атомы или ионы — могут выступать при этом в роли окислителей, т. е. взаимодействовать с металлами? Учащиеся без затруднений справляются и с этим вопросом, а учитель на доске делает запись — план рассмотрения общих химических свойств металлов.
Металлы взаимодействуют с:
1) неметаллами (Г2,S);
2) кислородом (O2);
3) водородом (Н2);
4) водой (Н2O);
5) растворами кислот (Н+);
6) растворами солей (Мn+);
7) оксидами металлов (металлотермия).
Последний пункт плана учащиеся, разумеется, не назовут, так как они не знают этого свойства, но для формирования целостного представления о химических свойствах металлов они записывают и этот пункт плана, а учитель говорит о том, что понятие металлотермии будет раскрыто несколько позже.
II. Взаимодействие металлов с неметаллами
Учителю необходимо обратить внимание учащихся на применение полученных ранее теоретических знаний для объяснения фактологического материала — химии металлов. Среди повторяемых вопросов: ионная химическая связь и ионные кристаллические решетки бинарных соединений металлов с неметаллами, основы номенклатуры таких соединений, окислительно-восстановительные реакции. Здесь необходимо подчеркнуть, что проблем с выведением формул бинарных соединений металлов с постоянным значением с. о. (щелочных, щелочноземельных, алюминия) не будет, так как всю необходимую информацию содержит ПСХЭ, например:
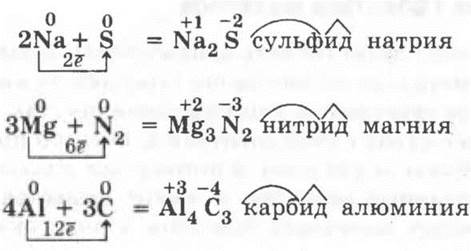
Другое дело, если металл проявляет разные с. о. В этом случае образование определенного продукта реакции будет зависеть от окислительных свойств неметалла, например, железо с хлором образует хлорид железа (III), так как хлор — сильный окислитель, а вот с серой — только сульфид железа (II), ибо сера уже менее сильный окислитель:
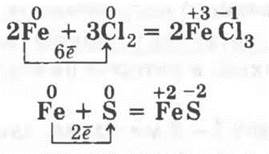
Для демонстрации мы предлагаем серию следующих опытов.
Взаимодействие металлов с галогенами
1. Взаимодействие сурьмы, железа, меди с хлором.
Для этого опыта потребуется предварительно получить хлор в пробирке с пробкой и газоотводной трубкой путем взаимодействия КМnO4 и НСl (тяга!):
![]()
Хлор собирают в три небольшие колбочки, которые затем закрывают пробками и используют для демонстрации взаимодействия металлов с ним.
1.1. Над колбой с хлором (разумеется, предварительно вынув пробку) держат кусочек сурьмы и пилочкой для ногтей или напильником аккуратно соскабливают порошок сурьмы. Кристаллы ее вспыхивают, падая в колбу, которая заполняется густым белым дымом, состоящим из смеси хлоридов сурьмы (III) и (V):
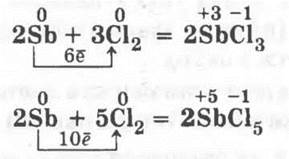
1.2. Берут тонкую стальную проволоку (12—15 см). Конец ее обматывают вокруг небольшого кусочка спички и поджигают ее. Когда проволока накалится, опускают ее в колбу с хлором. Кусочек спички гаснет, а проволока раскаляется и сгорает, образуя бурый хлорид железа (III).
1.3. Аналогично сжигают в хлоре тонкую медную проволоку:
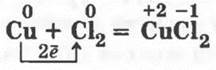
Это взаимодействие можно показать и в другой модификации: высыпать в колбу с хлором немного порошка меди. Она сгорит без предварительного нагревания (как и сурьма).
2. Взаимодействие металлов с бромом (под тягой или выставить штатив с пробиркой, в которой находится бром, за окно с наружной стороны).
В пробирку наливают 1—2 мл брома, закрепляют ее в лапке штатива и на всякий случай подставляют сосуд с водой, а затем опускают в нее свернутый в шарик небольшой кусочек алюминиевой фольги. Через некоторое время кусочек алюминия раскаляется и начинает бегать по поверхности жидкости, а из пробирки выделяются бурые пары брома:
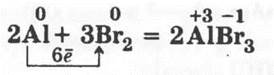
3. Взаимодействие металлов с йодом.
3.1. Смесь порошка алюминия с мелко-растертым йодом (1:15 по массе) помещают горкой в фарфоровую чашку (предварительно под ней будет неплохо постелить газету), а затем в середину кучки капают из пипетки несколько капель воды. Начинается бурная экзотермическая реакция:
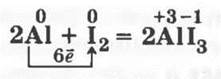
Смесь раскаляется, а иодид алюминия от теплоты реакции тут же разлагается, и йод улетучивается (фиолетовые пары). Металл же сгорает (пламя), взаимодействуя с кислородом воздуха, и превращается в оксид.
Эта демонстрация даст возможность повторить понятие о катализаторах (Н2O) и катализе (гетерогенный), а также об экзотермических реакциях и их разновидности — реакциях горения.
3.2. Аналогично демонстрируется и взаимодействие смеси порошков цинка и йода (1:1 по массе):
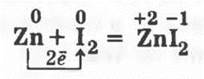
3.3. Широкую пробирку закрепляют в лапке штатива и помещают в нее несколько кристалликов йода. В ложечке для сжигания нагревают кусочек натрия до его расплавления и вносят ложечку в пробирку с йодом. Нагревают его, и натрий сгорает в парах йода:
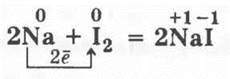
Взаимодействие металлов с серой
1. Взаимодействие натрия с серой. В фарфоровую ступку насыпают 1—2 г серы и втирают ее в стенки ступки. Затем в ступку помещают кусочек натрия величиной со спичечную головку и пестиком нажимают на металл, растирая его с серой. Слышатся хлопки небольших и неопасных взрывчиков, иногда появляется пламя:
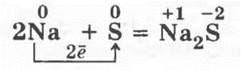
Когда реакция закончена, в ступку пипеткой добавляют воду и полученный раствор испытывают нитратом свинца или медным купоросом на ион S2-, так как произошло образование сульфида натрия.
2. Взаимодействие цинка с серой. Тщательно перемешивают порошки серы и цинка (1:1) и помещают их в фарфоровую чашечку. Небольшую порцию смеси берут пальцами и медленно посыпают сверху на пламя спиртовки. Наблюдаются синевато-белые вспышки, сопровождающие образование сульфида цинка. Оставшуюся смесь поджигают тлеющей лучинкой:
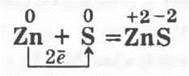
Взаимодействие металлов с кислородом
Учитель обращает внимание на продукты этого взаимодействия: солеобразующие оксиды двух типов — основные и амфотерные (по свойствам), а также на нормальные, смешанные оксиды и пероксиды (по составу), например:
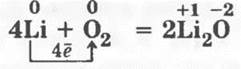 нормальный основный оксид лития
нормальный основный оксид лития
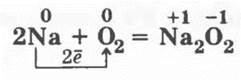 пероксид натрия
пероксид натрия
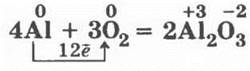 нормальный амфотерный оксид алюминия
нормальный амфотерный оксид алюминия
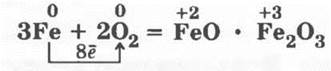 смешанный оксид железа (II, III)
смешанный оксид железа (II, III)
Будет правильным, если учитель рассмотрит строение пероксида натрия:

Наличие разного вида связей в одном веществе — еще один аргумент в пользу утверждения об относительности деления химических связей на виды, о единой природе всех видов химических связей.
Для демонстрации можно рекомендовать следующие опыты.
1. Горение натрия или лития в кислороде. Кусочки натрия или лития величиной с горошину помещают в ложечки для сжигания. В натрий втыкают 1—2 спичечные головки (это запал), а так как литий тверже натрия, то на него просто кладутся 1—2 спичечные головки с небольшим кусочком спички. Запал поджигается, и ложечки немедленно вносят в колбы с кислородом: натрий горит ярко-желтым, а литий — красновато-малиновым пламенем. На стенках колбы оседают, соответственно, пероксид натрия и оксид лития. В колбу, содержащую Na2О2, можно по окончании горения прилить воды и наблюдать бурное разложение пероксида:
![]()
Образование щелочи в результате этого опыта доказывается с помощью фенолфталеина.
Учитель может сказать о том, что Na2О2 можно использовать как регенератор кислорода на подводных лодках:
![]()
Нормальный оксид натрия получают из пероксида, прокаливая последний с натрием:
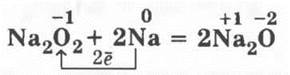
2. Горение магния можно показать и на воздухе, поджигая ленту магния. Если нет ленты, то ее легко приготовить из порошка магния. Берут полоску плотной бумаги шириной 1 см и длиной 10 см, смазывают ее клеем и густо посыпают порошком магния. После подсушивания полоску берут тигельными щипцами и поджигают. Если горящую ленту внести в колбу с кислородом, то она разгорается еще ярче.
Можно просто поместить горкой порошок магния на металлическую подложку, сверху положить 2—3 спичечные головки (запал), которые затем поджечь. Магний загорится и мгновенно сгорит яркими вспышками.
Получившийся при горении магния белый оксид можно растворить в кислоте, доказав тем самым, что он имеет основный характер.
3. Горение алюминия можно продемонстрировать в двух модификациях.
3.1. Порошок алюминия (обычная краска-серебрянка из хозяйственного магазина) помещают в ложечку для сжигания, сверху кладут запал (2—3 спичечные головки), который поджигают. Ложечку быстро вносят в колбу с кислородом. Алюминий горит ярким ослепительным пламенем. Учитель напоминает, что ребята наблюдают подобное, если поджигают обычные бенгальские огни.
3.2. В фарфоровую чашечку (лучше в металлический тигель) насыпают смесь порошков алюминия и перманганата калия (горкой) и сверху помещают спичечную головку, к которой затем прикасаются тлеющей лучинкой. Смесь воспламеняется яркими огнями мгновенно.
При этом происходят следующие химические реакции.
Разложение перманганата калия при нагревании:
![]()
Сгорание угля в выделяющемся кислороде:
![]()
Образующийся при горении угля газообразный оксид углерода (IV) увлекает за собой раскаленные частицы алюминия, которые сгорают в кислороде:
![]()
Взаимодействие металлов с водородом — образование гидридов
Это свойство разбирается только теоретически и было рассмотрено в предыдущей теме. Актуализация этой части данного урока состоит в том, чтобы еще раз показать школьникам, что даже отсутствие обозначений в графе водородных соединений у LA, IIA и IIIA групп ПСХЭ несет в себе информацию (элементы образуют такие соединения, но не летучие, а твердые, солеподобные, ионного типа — гидриды), и еще раз рассмотреть причины двойственного положения водорода ПСХЭ.
III. Взаимодействие металлов с водой
Рассмотрение этого общего свойства металлов позволит учащимся конкретизировать свои теоретические знания о ряде напряжений металлов, классификации оснований, зависимости скорости химической реакции от природы реагирующих веществ и от температуры и т. д. Учителю нужно будет только расставить соответствующие акценты по ходу урока. Он предлагает вспомнить, почему щелочные и щелочноземельные металлы имеют такие названия, спрашивает учащихся о том, как изменяется скорость реакции взаимодействия щелочных металлов с водой для ряда Li → Na → К (почему увеличивается?).
Взаимодействие щелочных металлов и кальция с водой
Очень эффектно смотрится демонстрация этого взаимодействия с помощью кодоскопа, на который помещаются чашечки Петри со сделанными на дне снаружи маркером или стеклографом надписями соответствующих символов: Li, Na, К. В чашечки приливается немного воды, добавляется несколько капель фенолфталеина и опускаются сравнительно одинаковые (со спичечную головку) кусочки щелочных металлов.
Лабораторно можно провести следующую модификацию этого опыта. На смоченный водой листок фильтровальной бумаги (края ее загнуть, чтобы не свалился бегающий кусочек металла) кладут очищенный кусочек натрия величиной со спичечную головку. Натрий быстро расплавляется, и происходит реакция, сопровождающаяся вспышкой.
Недостаток предыдущих опытов состоит в том, что учащиеся не наблюдают выделения водорода. Чтобы показать это, опыт проводят следующим образом. Пробирку с водой ставят в подставку или закрепляют в штативе и опускают в нее очищенный кусочек натрия. Над пробиркой укрепляют перевернутую воронку (рис. 9). Выделяющийся водород поджигают у отверстия воронки. Опыт надо проводить четко и быстро. (Спички держать наготове!) Когда прекратится реакция, в пробирку приливают несколько капель раствора фенолфталеина.
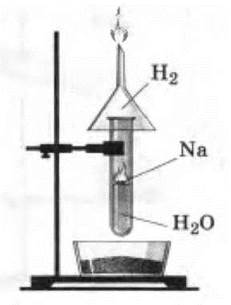
Рис. 9. Взаимодействие натрия с водой
Аналогично демонстрируют и взаимодействие кальция с водой.
Взаимодействие цинка с водой
Менее активные металлы, т. е. те, которым в качестве гидроксидов не соответствуют щелочи, реагируют с водой только при высоких температурах и образуют при этом водород и оксид металла:
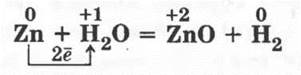
Учитель демонстрирует опыт. В тугоплавкую пробирку насыпают немного речного песка, который смачивают водой. С помощью широкой стеклянной трубочки аккуратно насыпают порошок или опилки цинка в пробирку, которую закрывают пробкой с газоотводной трубкой, и ее конец опускают в стакан с водой.
Опыт начинают с обогревания всей пробирки. Затем сильно нагревают цинк. Когда из пробирки выйдет почти весь воздух, конец газоотводной трубки подводят под перевернутую пробирку или небольшой цилиндр с водой (рис. 10). Пламя спиртовки время от времени переносят на песок, вода испаряется. Пары ее, проходя над нагретым цинком, вступают с ним в реакцию, образуется водород.
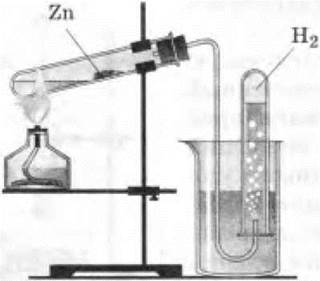
Рис. 10. Взаимодействие цинка с водой с образованием водорода
Взаимодействие магния с водой
Опыт можно проводить в двух модификациях.
1. В пробирку наливается немного воды, в которую аккуратно, с помощью широкой стеклянной трубочки присыпается порошок магния. Признаков химической реакции не видно. Затем содержимое пробирки нагревают до кипения. Заметно, выделение пузырьков водорода.
2. Можно показать горение магния не только в воздухе, но и в воде. Для опыта сгибают под прямым углом ручку у ложечки для сжигания. В ложечку с избытком насыпают порошок магния и поджигают его на пламени спиртовки или газовой горелки. На воздухе порошок магния горит медленно, как бы тлеет. Ложечку с горящим магнием быстро погружают в стакан или банку с водой. (Осторожно! Рука не должна помещаться над стаканом!) Магний ярко вспыхивает. Выделяющийся при этом водород также сгорает (рис. 11).
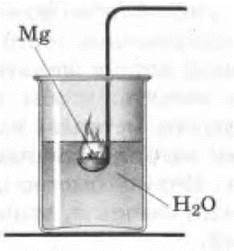
Рис. 11. Горение магния в воде
IV. Взаимодействие металлов с растворами кислот и солей
Рассмотрение этой части урока не представляет никаких методических затруднений для учителя, так как является повторением условий протекания реакций между металлами и кислотами, металлами и солями на основании положения металлов в ряду напряжений с условием образования растворимых солей в результате такого взаимодействия (работа с таблицей растворимости).
Эту часть урока можно провести в виде лабораторной работы по практическому осуществлению, например, следующих реакций:
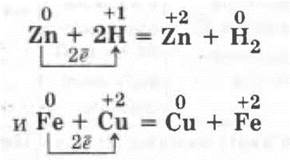
Само собой разумеется, что подобные реакции разбираются в свете ТЭД и в свете окислительно-восстановительных реакций.
V. Металлотермия
Разбирается как пропедевтика к рассмотрению способов получения металлов из их оксидов с помощью одного из пирометаллургических способов. Кроме рассмотренного в 8 классе демонстрационного опыта поджигания термита — производственной смеси Аl с Fe3O4 (здесь его неплохо было бы повторить), можно показать и кальциетермию, или, если не хватит времени на этом уроке, то демонстрация этого опыта на уроке по получению металлов будет весьма кстати. В железный тигель насыпают смесь из 2 г оксида меди (II) и 1 г опилок кальция. Тигель ставят в вытяжной шкаф и нагревают (следует отойти в сторону, так как реакция идет со взрывом!):
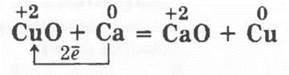
В заключение урока учитель разбирает с учащимися таблицу «Общие свойства металлов» (табл. 1), кроме граф «Нахождение в природе» и «Способы получения». Их, говорит он учащимся, мы рассмотрим на следующем уроке.
Таблица 1. Общие свойства металлов
|
|
Li |
K |
|
Ca |
Na |
Mg |
Al |
Mn |
Zn |
Cr |
|
Fe |
Ni |
Sn |
Pb |
(H) |
Cu |
Hg |
Ag |
Pt |
Au |
|
Способность атомов отдавать электроны (окисляться) |
|
Возрастает
|
|
||||||||||||||||||
|
Взаимодействие с кислородом воздуха |
Быстро окисляются при обычной температуре |
Медленно окисляются при обычной температуре или при нагревании |
Не окисляются |
||||||||||||||||||
|
Взаимодействие с водой |
При обычной температуре выделяется Н2и образуется гидроксид |
При нагревании выделяется Н2 и образуются оксиды |
Н2 из воды не вытесняют |
||||||||||||||||||
|
Взаимодействие с кислотами |
Вытесняют водород из разбавленных кислот |
Не вытесняют водород из разбавленных кислот |
|||||||||||||||||||
|
Реагируют с H2SO4 (конц.) и HNO3 любой концентрации, образуя соль, воду и продукт восстановления |
Реагируют с концентрированной и разбавленной HNO3 и с H2SO4(конц.) при нагревании |
С кислотами не реагируют, растворяются в «царской водке» (3VНСl и 1V HNO3) |
|||||||||||||||||||
|
Нахождение в природе |
Только в соединениях |
В соединениях и в свободном виде |
Главным образом в свободном виде |
||||||||||||||||||
|
Способы получения |
Электролиз расплавов соединений |
Восстановление углем, оксидом углерода (II); алюминотермией или электролизом водных растворов солей |
|
||||||||||||||||||
|
Способность ионов присоединять электроны (восстанавливаться) |
Li+ |
K+ |
|
Ca2+ |
Na+ |
Mg2+ |
Al3+ |
Mn2 |
Zn2+ |
Cr3+ |
|
Fe2+ |
Ni2+ |
Sn2+ |
Pb2+ |
(H)+ |
Cu2+ |
Hg2+ |
Ag+ |
Pt2+ |
Au3+ |
|
|
Возрастает
|
||||||||||||||||||||