Настольная книга учителя по химии 9 класс - поурочные разработки
Металлы, их положение в Периодической системе Д. И. Менделеева, строение атомов и кристаллов. Общие физические свойства металлов - Металлы
Цели урока. Повторить с учащимися положение металлов в ПСХЭ, особенности строения их атомов и кристаллов (металлическую химическую связь и кристаллическую металлическую решетку). Обобщить и расширить сведения учащихся о физических свойствах металлов и их классификации.
Оборудование и реактивы. Коллекции образцов металлов; образцы монет и медалей. Многочисленные репродукции и фотографии семи чудес света и произведений искусства из металлов и сплавов.
I. Века медный, бронзовый, железный
Эту часть урока учитель проводит в форме рассказа с элементами беседы и сопровождает его демонстрацией наглядного материала.
Век медный. К концу каменного века человек открыл возможность использования металлов для изготовления орудий труда. Первым таким металлом была медь.
Период распространения медных орудий называют энеолитом или хальколитом, что в переводе с греческого означает «медь». В наши дни временные рамки его определить сложно, но примерно этот период датируется концом четвертого — началом третьего тысячелетия до н. э., так как энеолит схож с неолитом. Это объясняется тем, что в медном веке медные орудия труда не вытеснили каменные. Медь обрабатывалась с помощью каменных орудий методом холодной ковки. Самородки меди превращались в изделия под тяжелыми ударами молота. В начале медного века из меди делали лишь мелкие орудия, украшения, предметы домашней утвари, поскольку этот металл слишком мягок в чистом виде, чтобы изготавливать из него крупные режущие орудия.
Именно с открытием меди и других металлов стала зарождаться профессия кузнеца. К людям этой профессии разные племена относились по-разному: где-то их уважали, где-то боялись. Например, в России кузнецов недолюбливали, испытывали к ним суеверный страх, это подтверждает этимология слова «кузнец», которое произошло от слова «козни».
Позже появилось литье, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую.
Век бронзовый. В археологии это древнейший период употребления металлов, когда железо еще не было известно.
Бронза — сплав меди и олова. Хронологические границы бронзового века датируются с начала 3-го тысячелетия до н. э. до начала 1-го тысячелетия до н. э. Большими преимуществами бронзы в сравнении с медью и другими известными металлами являются более низкая температура плавления (700— 900 °С) и в особенности ее более высокие литейные качества и значительно большая прочность.
Медные руды встречаются довольно часто, а оловянные — значительно реже, поэтому бронза получила распространение там, где имелись оба эти металла, например в Хорасане (Иран), Малой Азии и северо-западной Аравии, а в Европе — в Испании, Англии и Чехии. В других местах, где своего олова не было, его старались заменить сурьмой («сурьмяная бронза»), мышьяком, свинцом и цинком.
В странах Передней Азии и в Индии уже в 3-м тысячелетии до н. э. появилось производство бронзовых изделий. В Египте бронзовый век начался во 2-м тысячелетии до н. э.
Далее учитель рассказывает о роли золота, серебра и меди для производства монет, а бронзы — для изготовления скульптур и других произведений искусства.
Железный век. По археологической классификации третий и последний период первобытной эпохи, характеризующийся распространением железной металлургии и железных орудий, и знаменует собой железный век, представление о котором возникло впервые еще в античном мире. В XVIII — начале XIX в. гипотезу о железном веке развивали уже многие ученые, в том числе и российские (А. Н. Радищев). В современном значении этот термин был введен в употребление в середине XIX в. датским археологом К. Ю. Томсоном и вскоре распространился в литературе наряду с терминами «каменный век» и «бронзовый век ».
В отличие от других металлов железо, кроме метеоритного, почти не встречается в природе в чистом виде. Наиболее древний сохранившийся образец кованого железа обнаружен при изучении большой пирамиды Хеопса и принадлежит к 2000— 1500 гг. до н. э. Однако не только в Египте, но и в Древней Греции было известно о существовании железа. Ведь герои поэм легендарного Гомера облачались в доспехи и сражались оружием из железа и меди.
Астрологи того времени утверждали, что каждой планете на небе соответствует свой металл на Земле, например красноватому Марсу — гремящее в боях железо. Каждая планета издревле обозначалась особым знаком. Этими же знаками долгое время (вплоть до конца XIX в.) обозначали и «родственные» этим планетам металлы.
Ученые предполагают, что первое железо, попавшее в руки человека, было метеоритного происхождения. Не случайно на некоторых древних языках железо именуется «небесным камнем». Самый крупный железный метеорит нашли в Африке, он весил около 60 т. А во льдах Гренландии нашли железный метеорит весом 33 т. Уже в древности из этих небесных тел, так как они были прочными и твердыми, изготавливались различные предметы. Современные химические анализы огромного числа метеоритов, упавших на нашу планету, показали, что в составе железных метеоритов на долю железа приходится 91%.
Начало производства железа из его руд в Древнем Египте, Индии и других странах было положено около 4 тыс. лет назад, потому что возросла потребность людей в железных предметах — мечах, плугах и других изделиях, — а метеоритного железа на Земле было гораздо меньше, чем химически связанного железа. Поэтому огромное значение имело открытие способа получения железа из железных руд. Эти открытия основывались на наблюдении за процессами горения. В тех случаях, когда вместе с топливом случайно нагревались куски железной руды, железо при соприкосновении с раскаленным древесным углем восстанавливалось. Постепенно человек перешел к сознательному воспроизведению процесса выплавки железа.
В Америке, Австралии и на большинстве островов Тихого океана железо стало известно лишь во 2-м тысячелетии н.э. вместе с появлением в этих областях европейцев. Предполагают, что железо было известно некоторым племенам Центральной и Северной Африки, однако каких-либо достоверных данных по этому вопросу нет. Культурой железного века называется обычно культура первобытных племен Европы и Азии, живших к северу от области древних рабовладельческих цивилизаций. В них металлургия железа распространилась в VIII—VII вв. до н. э.
Так начался «железный век» — тот век, в котором мы и сейчас еще живем. Ведь в настоящее время железные сплавы составляют почти 90% всего количества металлов и металлических сплавов.
II. Положение металлов в Периодической системе и строение их атомов
Эта часть урока проводится в форме беседы. Учитель обобщает высказывания учащихся следующим выводом.
Если провести диагональ от В к At через элементы главных подгрупп, то по ней и над ней будут располагаться неметаллы, а под ней — металлы. У учеников сразу же возникает недоумение: какая же это диагональ, ведь образуется ломаная линия, поэтому учитель демонстрирует не только короткопериодный вариант Периодической системы, но и длинно-периодный, на котором можно показать именно диагональ, а не ломаную линию.
Для короткопериодного варианта ребята должны запомнить, что четные ряды больших периодов состоят только из металлов, равно как и все побочные подгруппы ПСХЭ представлены только металлами.
В итоге из 110 элементов ПСХЭ к металлам относятся 88.
Однако еще раз подчеркивает учитель, деление элементов на металлы и неметаллы условно. Так, например, металл германий обладает многими неметаллическими свойствами. Хром, алюминий и цинк — типичные металлы, но образуют соединения, в которых проявляют неметаллические свойства: NaAlO2, K2ZnO2, К2СrO4 или К2Сr2O7. Теллур и йод — типичные неметаллы, но имеют некоторые свойства, присущие металлам (например, металлический блеск).
Из положения металлов в ПСХЭ можно определить и особенности их строения:
1) небольшое число (1—3) электронов на внешнем уровне (здесь учитель сразу ставит проблемный вопрос: а почему V и Ро, атомы которых содержат, соответственно, 5ē и 6ē, являются металлами? — что позволяет показать значение второго параметра);
2) сравнительно большой радиус атома (вывод, который и разрешил проблему; в подтверждение этого учитель приводит еще один пример — бор, атомы которого имеют 3ē на внешнем уровне, но маленький радиус атома, является типичным неметаллом).
III. Строение кристаллов металлов
Учитель просит учащихся вспомнить, что такое металлическая химическая связь и металлическая кристаллическая решетка. Веществам с металлической связью присущи металлические кристаллические решетки, которые обычно изображают как на рисунке 1. В узлах находятся катионы и атомы металлов. Обобществленные электроны (на рисунке они показаны точками) электростатически притягивают катионы металлов, расположенные в узлах кристаллической решетки, обеспечивая ее стабильность и прочность.
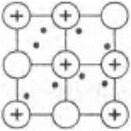
Рис. 1. Кристаллическая решетка металлов
Следовательно, металлическая связь — это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической решетки, осуществляемая обобществленными внешними электронами.
Схематично такую связь, напоминает учитель, можно записать так:
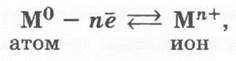
где М — символ элемента-металла.
Металлы имеют три типа кристаллических решеток: кубическая гранецентрированная, гексагональная и кубическая объемно-центрированная (рис. 2). Они являются плотноупакованными структурами. В кубической плотноупакованной структуре атомные слои чередуются таким образом, что лишь четвертый по счету слой повторяет первый слой, т. е. характерно чередование по типу АВСАВС..., где А, В, С — условные обозначения слоев. Многие металлы кристаллизуются в одной из двух кубических структур. Так, кристаллы щелочных металлов имеют кубическую объемно-центрированную структуру, а металлы восьмой группы — кубическую гранецентрированную. В гексагональной структуре атомы располагаются в слоях, чередующихся друг с другом по типу АВАВ... Такой тип структур очень распространен среди металлов.
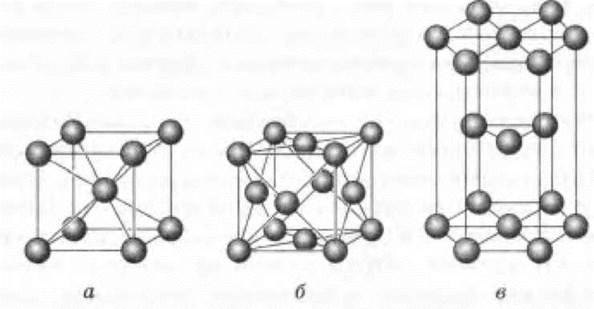
Рис. 2. Кристаллические решетки металлов:
а — кубическая объемно-центрированная; б — кубическая гранецентрированная; в — гексагональная объемно-центрированная
Электроны, осуществляющие металлическую связь, принадлежат не двум отдельным атомам, а свободно перемещаются по всему кристаллу. Следует отметить, подчеркивает учитель, что тип связи в металлических кристаллах отличается от остальных тем, что здесь нет какой-либо ионной связи и в то же время невозможно образование ковалентных двух электронных связей между соседними атомами. Другое дело в парах металлов, где наблюдается именно этот тип связи.
Учитель демонстрирует коллекцию металлов (лучше, если это будут раздаточные материалы для лабораторного ознакомления с образцами металлов). Хорошо, если есть ампулы со ртутью и щелочными металлами. Если же они отсутствуют, то ртуть демонстрируют с помощью обычного медицинского градусника. Препараты натрия нужно просто приготовить, так как вследствие большой химической активности щелочные металлы быстро окисляются и блестящая поверхность их тускнеет. Блестящие слои щелочных металлов можно получить и сохранить следующими способами.
1. Подбирают по диаметру две пробирки, так чтобы одна из них входила в другую очень плотно, как поршень в цилиндр. Более широкая пробирка должна быть несколько короче. В нее кладут кусочек натрия и расплавляют его, опуская пробирку в горячую воду. Затем узкую пробирку вставляют в широкую и, надавливая, вытесняют металл в промежуток между пробирками. Промежуток вверху заливают парафином или воском (рис. 3). Если пробирки хорошо подогнаны друг к другу, то приготовленный образец сохраняет блеск на долгие месяцы.
![]()
Рис. 3. Приспособление для демонстрации металлического блеска щелочных металлов
2. Берут трубку диаметром 7—8 мм и длиной около 15 см. Из керосина вынимают кусок натрия, обтирают фильтровальной бумагой, срезают скальпелем или острым ножом верхний слой. Кусок металла кладут на стол, предварительно подстелив лист бумаги, и вдавливают в него стеклянную трубку так, чтобы в ней образовался слой в 1—1,5 см. Стеклянной палочкой проталкивают металл до середины трубки и, вставив вторую палочку с другого конца, обжимают его, сдавливая и слегка вращая стеклянные палочки. Такой обжатый столбик металла долго сохраняет блестящую поверхность в месте соприкосновения его со стеклом. По краям он сразу покрывается пероксидами и другими продуктами окисления, которые предохраняют металл от проникновения кислорода в глубь столбика. Для длительного сохранения образца трубку с обоих концов заплавляют, в этом случае она должна быть подлиннее.
3. Щелочной металл можно расплавить и поместить между двумя стеклянными пластинками. Для этого стеклянные пластинки кладут на нагретый песок. Когда они разогреются, на одну из них кладут кусочек натрия, очищенного от керосина и поверхностных соединений. Когда металл начнет плавиться, то его прикрывают другой пластинкой. Образуется зеркало щелочного металла. Для предохранения от окисления ребра пластинок заливают клеем, парафином или воском.
IV. Физические свойства металлов
Учитель подчеркивает, что физические свойства металлов определяются именно их строением.
Твердость. Все металлы, кроме ртути, при обычных условиях — твердые вещества. Однако это свойство различно у каждого из металлов (рис. 4). Самые мягкие — натрий, калий и индий — можно резать ножом, самый твердый — хром — царапает стекло.
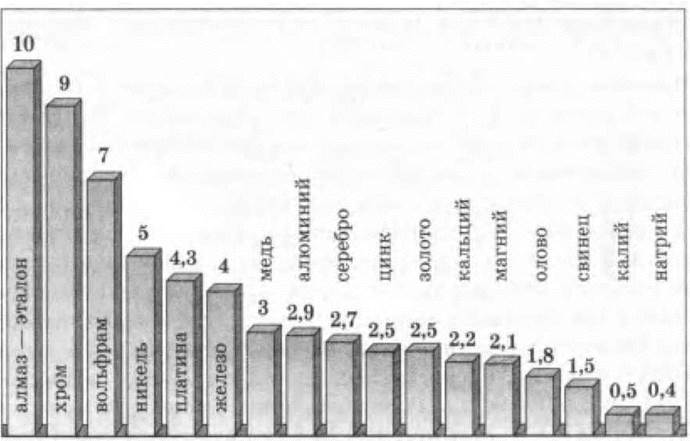
Рис. 4. Относительная твердость некоторых металлов
Плотность. Металлы делятся на легкие (с плотностью до 5 г/см3) и тяжелые (с плотностью больше 5 г/см3). К легким, например, относятся Li, Na, К, Mg, Ад, к тяжелым — Zn, Сг, Sn, Pb, Ag,Au (рис. 5).
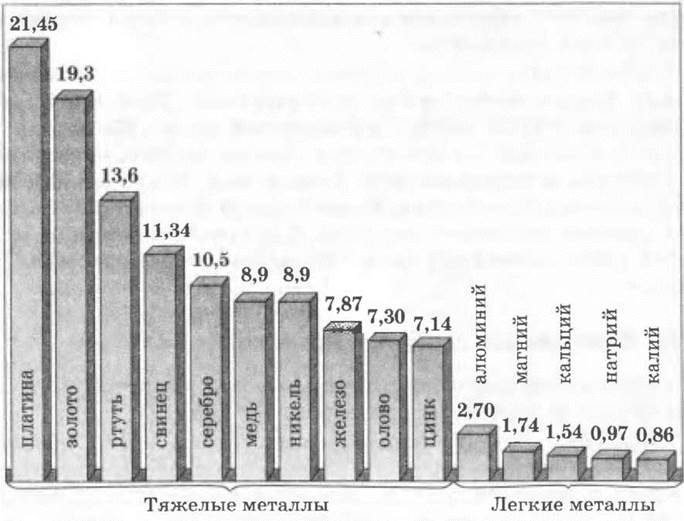
Рис. 5. Плотность некоторых металлов
Плавкость. Металлы делятся на легкоплавкие и тугоплавкие (рис. 6).
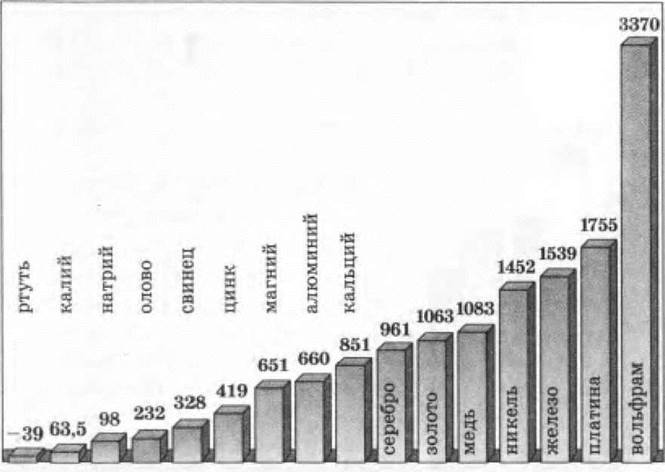
Рис. 6. Температура плавления некоторых металлов
Электро- и теплопроводность. Высокая электро- и теплопроводность металлов обусловлена их строением. Хаотически движущиеся в металле электроны под воздействием приложенного электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток. При повышении температуры металла возрастают амплитуды колебаний атомов и ионов, находящихся в узлах кристаллической решетки. Это затрудняет перемещение электронов, электрическая проводимость металлов падает. При низких температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость металлов резко возрастает. Вблизи абсолютного нуля сопротивление у металлов практически отсутствует, у большинства из них появляется сверхпроводимость.
Следует отметить, что неметаллы, обладающие электрической проводимостью (например, графит) при низких температурах, наоборот, не проводят электрический ток из-за отсутствия свободных электронов. И только с повышением температуры и разрушением некоторых ковалентных связей электрическая проводимость их начинает возрастать.
Наибольшую электропроводность имеют серебро, медь, а также золото, алюминий, железо; наименьшую — марганец, свинец, ртуть (рис. 7).
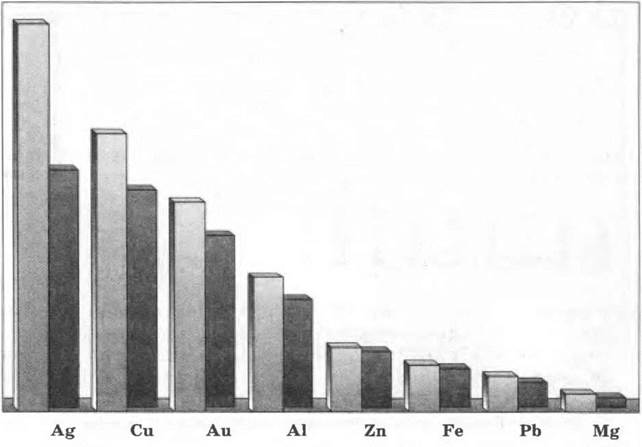
Рис. 7. Относительная теплопроводность (белые столбики) и электрическая проводимость (темные столбики) некоторых металлов
Чаще всего в той же последовательности, как и электропроводность, изменяется и теплопроводность металлов. Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь с колеблющимися ионами и атомами, обмениваются с ними энергией. Поэтому происходит быстрое выравнивание температуры по всему куску металла.
Металлический блеск. Электроны, заполняющие межатомное пространство, отражают световые лучи, а не пропускают, как стекло, поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Причем для большинства металлов в равной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый или серый цвет. Только золото и медь в большей степени поглощают короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового спектра, поэтому имеют желтый и медный цвета.
Самые блестящие металлы — ртуть, серебро, палладий. В порошке все металлы, кроме Ад и Mg, теряют блеск и имеют черный или темно-серый цвет.
Пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, поэтому металлы характеризуются высокой пластичностью.
Аналогичное воздействие на твердое вещество с ковалентными связями (атомной кристаллической решеткой) приводит к их разрыву. Разрыв связей в ионной решетке приводит к взаимному отталкиванию одноименных заряженных ионов (рис. 8). Поэтому вещества с атомными и ионными кристаллическими решетками хрупкие.
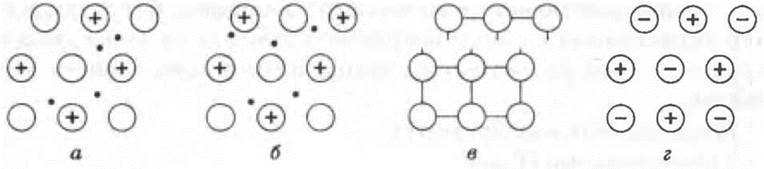
Рис. 8. Смещение слоев в кристаллических решетках при механическом воздействии:
а, б, — металлической; в — атомной; г — ионной