Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей - Расчеты по химическим формулам и уравнениям реакций - МЕТОДЫ ПОЗНАНИЯ В ХИМИИ. ХИМИЯ И ЖИЗНЬ
Тесты с кратким ответом с решениями
1. Определите массу воды в 90 г 10,0%-ного раствора сульфата натрия.
Ответ: ____ г. (Запишите число с точностью до целых.)
Ответ дайте в виде целого числа без указания единиц измерения.
2. Определите массу нитрата серебра в 400 мл 12%-ного раствора с плотностью 1,11 г/мл.
Ответ: ____ г. (Запишите число с точностью до целых.)
3. К 250 г раствора нитрата калия с массовой долей 0,12 добавили 10 г этой же соли и 40 г воды. Определите массовую долю соли в полученном растворе.
Ответ: ____ %. (Запишите число с точностью до целых.)
4. Определите объем (н.у.) аммиака NH3, который нужно растворить в 2 литрах воды (ρ(Н2O) = 1 г/мл) для получения 10,22%-ного раствора аммиака.
Ответ: ____ л. (Запишите число с точностью до целых.)
5. Из 200 мл 63%-ного раствора нитрата калия (ρ = 1,35 г/мл) при охлаждении выпал осадок соли массой 120 г. Определите массовую долю соли в оставшемся растворе.
Ответ:___ %. (Запишите число с точностью до целых.)
6. Определите массу (в граммах) 6%-ного раствора гидроксида калия, полученного разбавлением 180 г 20%-ного гидроксида калия.
Ответ: ___ г. (Запишите число с точностью до целых.)
7. Определите массовую долю соли в растворе, полученном при смешивании 240 г 12%-ного раствора хлорида натрия и 160 г 22%-ного раствора этой же соли.
Ответ: ___ %. (Запишите число с точностью до целых.)
8. Смешали 150 мл 16%-ной серной кислоты с плотностью 1,11 г/мл и 250 мл 30%-ной серной кислоты с плотностью 1,22 г/мл. Определите массовую долю кислоты в полученном растворе.
Ответ: ___ %. (Запишите число с точностью до целых.)
9. Определите объем воды (ρ(Н2O) = 1 г/мл), которую надо добавить к 250 мл 20%-ного раствора гидроксида натрия с плотностью ρ = 1,22 г/мл для получения 11,84%-ного раствора гидроксида натрия.
Ответ: ___ мл. (Запишите число с точностью до целых.)
10. Определите объем 4%-ного раствора азотной кислоты с плотностью 1,02 г/мл, который можно получить из 96,9 мл 24%-ного раствора этой кислоты с плотностью 1,14 г/мл.
Ответ: ___ мл. (Запишите число с точностью до целых.)
Тесты с кратким ответом для самостоятельного решения
11. Определите массу воды в 120,0 г 15,0%-ного раствора гидроксида калия.
Ответ: ___ г. (Запишите число с точностью до целых.)
12. Определите массу хлорида бария в 0,5 л 14%-ного раствора с плотностью 1,13 г/мл.
Ответ: ___ г. (Запишите число с точностью до целых.)
13. К 320 г раствора хлорида натрия с массовой долей 0,10 добавили 40 г этой же соли и 640 г воды. Определите массовую долю соли в полученном растворе.
Ответ:___ %. (Запишите число с точностью до десятых.)
14. Определите объем воды (ρ(Н2О) = 1 г/мл), в которой нужно растворить 50 л (н.у.) хлороводорода для получения 16,92%-ного раствора соляной кислоты.
Ответ: ___ мл. (Запишите число с точностью до целых.)
15. При упаривании 650 г 8%-ного раствора натриевой селитры получился раствор с содержанием соли 13%. Определите массу выпаренной при этом воды.
Ответ: ___ г. (Запишите число с точностью до целых.)
16. Определите массу 24%-ного раствора гидроксида калия, необходимого для приготовления 480 г 10%-ного раствора гидроксида калия.
Ответ: ___ г. (Запишите число с точностью до целых.)
17. Определите массовую долю соли в растворе, образующемся при смешивании 360 г 20%-ного нитрата калия и 240 г 8%-ного раствора этой же соли.
Ответ: ___ %. (Запишите число с точностью до целых.)
18. Смешали 300 г 30%-ного раствора серной кислоты и 200 г 55%-ного раствора того же вещества. Определите массовую долю кислоты в полученном растворе.
Ответ: ___ %. (Запишите число с точностью до целых.)
19. Определите массовую долю кислоты в растворе, полученном при смешивании 150 мл 14%-ного раствора HNO3 (ρ = 1,080 г/мл) и 250 мл 4%-ного раствора HNO3 (ρ = 1,022 г/мл).
Ответ: ___ %. (Запишите число с точностью до десятых.)
20. Из 500 мл 26%-ного раствора серной кислоты (ρ = 1,19 г/мл) надо приготовить 17%-ный раствор. Определите объем (в миллилитрах) необходимой для этого воды.
Ответ: ___ мл. (Запишите число с точностью до целых.)
Ответы на тесты раздела 4.3.1
1. 81 2. 53 3. 13 4. 300 5. 33 6. 600 7. 16 8. 25 9. 210 10. 650 11. 102 12. 79 13. 7,2 14. 400 15. 250 16. 200 17. 15 18. 40 19. 7,9 20. 315
Решения тестов раздела 4.3.1
Решение 1. Раствор — однородная система, которая состоит из растворенного вещества и растворителя. Отсюда: ![]() Массовая доля вещества в растворе (w) — отношение массы растворенного вещества к массе раствора. Отсюда:
Массовая доля вещества в растворе (w) — отношение массы растворенного вещества к массе раствора. Отсюда: ![]()
Зная массу раствора mр-ра = 90 г и массовую долю w = 0,10, находим массу вещества:
![]()
Зная массу раствора mр-ра = 90 г и массу вещества mв-ва = 9 г, находим массу воды в растворе:
![]()
Ответ: 81.
Решение 2. Плотность раствора — это отношение массы раствора к объему раствора: ![]() Отсюда получаем формулу для массы раствора:
Отсюда получаем формулу для массы раствора: ![]() формулу для массовой доли:
формулу для массовой доли: ![]() и формулу для массы вещества в растворе:
и формулу для массы вещества в растворе: ![]() Зная объем раствора V = 400 мл, массовую долю вещества в растворе w = 0,12 и плотность раствора ρ = 1,11 г/мл, находим массу вещества в растворе
Зная объем раствора V = 400 мл, массовую долю вещества в растворе w = 0,12 и плотность раствора ρ = 1,11 г/мл, находим массу вещества в растворе ![]()
Ответ: 53.
Решение 3. Зная массу первого раствора mр-ра 1 = 250 г и массовую долю первого раствора wi = 0,12, находим массу вещества в этом растворе: ![]()
Зная, что к первому раствору массой 250 г добавили 10 г соли и 40 г воды, находим массу второго раствора: ![]()
![]()
Зная, что к первому раствору, содержащему 30 г соли, добавили 10 г соли, находим массу вещества во втором растворе: ![]() Находим массовую долю вещества во втором растворе:
Находим массовую долю вещества во втором растворе: ![]()
![]()
Ответ: 13.
Решение 4. Пусть масса аммиака равна х г, то есть m(NH3) = х г.
Зная объем воды V(H2O) = 2 л = 2000 мл и плотность воды ρ(Н2O) = 1 г/мл, находим массу воды: ![]()
![]()
Зная массу воды (2000 г) и массу аммиака (х г), находим mр-ра = (2000 + х) г.
Составим уравнение: ![]()
![]() Откуда
Откуда ![]()
![]()
Зная массу аммиака (227,7 г) и молярную массу аммиака (17 г/моль), находим количество вещества аммиака ![]()
![]()
Зная количество вещества аммиака (13,39 моль) и молярный объем газа при нормальных условиях (22,4 л/моль), находим объем аммиака: ![]()
Ответ: 300.
Решение 5. Зная объем раствора и его плотность, находим массу первого раствора:
![]()
Зная массу раствора и массовую долю вещества в растворе, находим массу вещества в первом растворе: ![]()
![]()
Поскольку из первого раствора при охлаждении выпал осадок соли массой mосадка = 120 г, то находим массу второго раствора и массу вещества во втором растворе:
![]()
Находим массовую долю вещества во втором растворе: ![]()
Ответ: 33.
Решение 6. Решая задачи на приготовление растворов, следует помнить, что масса вещества в разбавленном растворе равна массе вещества в концентрированном растворе.
Зная массу раствора и массовую долю вещества в растворе, находим массу вещества в 20%-ном растворе: ![]()
![]()
Поскольку 6%-ный раствор получают из 20%-ного раствора добавлением воды, то масса вещества в 6%-ном растворе остается прежней: ![]()
Зная для второго вещества массовую долю вещества в растворе (0,06) и массу вещества в этом растворе (36 г), находим массу этого раствора: ![]()
![]()
Ответ: 600.
Решение 7. Находим массу соли в первом (12%-ном) растворе:
![]()
Находим массу соли во втором (22%-ном) растворе: ![]()
Поскольку третий раствор получаем при смешивании двух первых растворов, то имеем:
![]()
Находим массовую долю вещества в третьем растворе:
![]()
Ответ: 16.
Решение 8. Находим массы первых двух растворов и массы вещества в них:
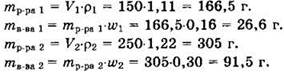
Поскольку третий раствор получаем при смешивании двух первых растворов, то имеем:
![]()
Находим массовую долю вещества в третьем растворе:
![]()
Ответ: 25.
Решение 9. Находим массу исходного раствора и массу вещества гидроксида натрия в нем:
![]()
Второй раствор получаем добавлением воды к первому раствору, поэтому масса вещества во втором растворе равна массе вещества в первом растворе: ![]() Находим массу второго раствора:
Находим массу второго раствора:
![]()
С другой стороны: ![]() Отсюда
Отсюда ![]()
Зная массу и ПЛОТНОСТЬ воды, находим ее объем: ![]()
Ответ: 210.
Решение 10. Из формулы ![]() имеем для 24%-ного раствора:
имеем для 24%-ного раствора: ![]() и для 4%-ного раствора:
и для 4%-ного раствора: ![]() Поскольку 4%-ный раствор азотной кислоты готовится добавлением воды к 24%-ному раствору, то
Поскольку 4%-ный раствор азотной кислоты готовится добавлением воды к 24%-ному раствору, то ![]() Отсюда
Отсюда ![]() Находим
Находим ![]()
Ответ: 650.