Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Закономерности изменения свойств элементов и их соединений по периодам и группам - Периодический закон и периодическая система химических элементов Д.И. Менделеева - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Наименьший атомный радиус имеет
1) азот
2) кислород
3) фосфор
4) сера
2. Наибольшие металлические свойства проявляет
1) алюминий
2) бериллий
3) магний
4) натрий
3. Наименьшие неметаллические свойства проявляет
1) кремний
2) кислород
3) сера
4) фосфор
4. Наибольшую электроотрицательность имеет
1) хлор
2) кислород
3) фтор
4) сера
5. Сила оснований возрастает в ряду
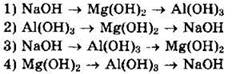
6. Сила кислот возрастает в ряду
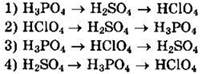
7. В периоде слева направо
1) радиус атома увеличивается
2) число электронов на внешнем уровне атома не меняется
3) число электронных уровней не меняется
4) заряд ядра атома уменьшается
8. В главной подгруппе сверху вниз
1) электроотрицательность атомов увеличивается
2) металлические свойства простых веществ ослабевают
3) высшая степень окисления атомов увеличивается
4) сила высших кислот уменьшается
9. Формула оксида, соответствующая элементу седьмой группы в его высшей степени окисления,
1) ЭО3
2) Э2O7
3) Э2O5
4) ЭO2
10. Формула гидрида, соответствующая элементу пятой группы в его низшей степени окисления,
1) ЭН3
2) ЭН4
3) ЭН
4) ЭН2
Тесты с выбором ответа для самостоятельного решения
11. В периоде слева направо
1) электроотрицательность атомов уменьшается
2) сила высших оснований увеличивается
3) неметаллические свойства простых веществ увеличиваются
4) высшая степень окисления атомов не меняется
12. В периоде слева направо
1) радиус атома уменьшается
2) число электронов на внешнем уровне атома не меняется
3) число электронных уровней увеличивается
4) заряд ядра атома не меняется
13. В группе сверху вниз
1) электроотрицательность атомов увеличивается
2) сила высших оснований увеличивается
3) неметаллические свойства простых веществ усиливаются
4) высшая степень окисления атомов увеличивается
14. В группе сверху вниз
1) электроотрицательность атомов не меняется
2) металлические свойства простых веществ ослабевают
3) сила высших кислот увеличивается
4) высшая степень окисления атомов не меняется
15. Увеличению электроотрицательности в ряду сходных элементов соответствует уменьшение
1) энергии ионизации атома
2) неметаллических свойств
3) радиуса атома
4) силы высших кислородных кислот
16. Уменьшению радиуса в ряду сходных элементов соответствует уменьшение
1) силы высших кислородных кислот
2) силы оснований
3) энергии ионизации атома
4) неметаллических свойств
17. Ядро атома химического элемента содержит 33 протона. Кислота, образованная этим элементом в высшей степени окисления,
1) Н3ЭO4
2) Н2ЭO4
3) НЭO2
4) Н2ЭO3
18. Ядро атома химического элемента содержит 20 протонов. Гидроксид этого элемента
1) ЭОН
2) Э(ОН)2
3) Э(ОН)3
4) Э(ОН)4
19. Какую электронную конфигурацию атома имеет химический элемент, формула высшего оксида которого Э2O5?
1) 1s22s22p5
2) 1s22s22p1
3) 1s22s22p63s23p3
4) 1s22s22p63s23p63d54s2
20. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
![]()
Ответы на тесты раздела 1.2.1
1. 2 2. 4 3. 1 4. 3 5. 2 6. 1 7. 3 8. 4 9. 2 10. 1 11. 3 12. 1 13. 2 14. 4 15. 3 16. 2 17. 1 18. 2 19. 3 20. 1
Решения тестов раздела 1.2.1
Решение 1. В периодах слева направо радиус атомов уменьшается, в главных подгруппах сверху вниз радиус атомов увеличивается. Радиус атома фосфора больше, чем радиус атома азота или атома серы. Радиус атома кислорода меньше, чем радиус атома азота или атома серы.
Ответ: 2.
Решение 2. Металлические свойства — это способность отдавать электроны. Металлические свойства усиливаются с увеличением радиуса атома. В периодах слева направо металлические свойства ослабевают, в главных подгруппах сверху вниз металлические свойства усиливаются. Металлические свойства ослабевают в ряду натрий — магний — алюминий и в ряду магний — бериллий.
Ответ: 4.
Решение 3. Неметаллические свойства — это способность принимать электроны. Неметаллические свойства усиливаются с уменьшением радиуса атома. В периодах слева направо неметаллические свойства усиливаются, в главных подгруппах сверху вниз неметаллические свойства ослабевают. Неметаллические свойства усиливаются в ряду кремний — фосфор — сера и в ряду сера — кислород.
Ответ: 1.
Решение 4. Электроотрицательность — это способность атома в молекуле притягивать к себе электроны. Электроотрицательность уменьшается с уменьшением радиуса атома. В периодах слева направо электроотрицательность увеличивается, а в главных подгруппах сверху вниз электроотрицательность уменьшается. Электроотрицательность увеличивается от серы к хлору, от серы к кислороду, от хлора к фтору, от кислорода к фтору.
Ответ: 3.
Решение 5. Как правило, основные свойства гидроксидов усиливаются с возрастанием металлических свойств атомов металла, образующего гидроксид. Основные свойства ослабевают в периодах слева направо и возрастают в главных подгруппах сверху вниз.
Ответ: 2.
Решение 6. Как правило, кислотные свойства высших кислородных кислот усиливаются с возрастанием неметаллических свойств атома неметалла, образующего кислоту. Кислотные свойства возрастают в периодах слева направо и ослабевают в главных подгруппах сверху вниз.
Ответ: 1.
Решение 7. В периоде слева направо радиус атомов уменьшается, число электронов на внешнем уровне увеличивается, число электронных уровней, равное номеру периода, не меняется, заряд ядра, равный номеру элемента, увеличивается.
Ответ: 3.
Решение 8. В главных подгруппах сверху вниз радиус атомов увеличивается, электроотрицательность уменьшается, сила высших кислот уменьшается, высшая степень окисления атомов, численно равная номеру группы, не меняется.
Ответ: 4.
Решение 9. Номер группы показывает число валентных электронов атома. Атом находится в высшей степени окисления, когда отданы все валентные электроны, поэтому высшая степень окисления элемента седьмой группы, кроме фтора, равна +7. Формула оксида элемента со степенью окисления +7 Э2О7, например Cl2O7.
Ответ: 2.
Решение 10. Номер группы показывает число валентных электронов атома. Атом переходит в низшую степень окисления, дополняя свою оболочку до восьмиэлектронной оболочки соответствующего инертного газа. Элемент пятой группы имеет пять валентных электронов и, переходя в низшую степень окисления, принимает три электрона. Его степень окисления становится равной -3. Соответствующий гидрид имеет формулу ЭН3, например NH3.
Ответ: 1.