Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) - НЕОРГАНИЧЕСКАЯ ХИМИЯ
Тесты с выбором ответа с решениями
1. Раствор нитрата свинца(II) реагирует с
1) серебром
2) цинком
3) медью
4) ртутью
2. Раствор хлорида натрия реагирует с раствором
1) KNO3
2) КОН
3) HNO3
4) AgNO3
3. Кислую и щелочную среду соответственно имеют водные растворы
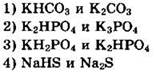
4. Твердый остаток образуется при прокаливании
![]()
5. Оксид металла образуется при разложении
1) KNO3
2) AgNO3
3) NH4NO3
4) Cu(NO3)2
6. И с разбавленной серной кислотой, и с гидроксидом калия реагирует
1) NH4NO2
2) FeCl3
3) СаСO3
4) Na2SiO3
7. Реагируют друг с другом в водном растворе
![]()
8. Хлорид железа(III) реагирует в водном растворе с каждым из двух веществ
![]()
9. При взаимодействии хлорида алюминия в водном растворе с избытком гидроксида натрия образуются
![]()
10. Двойной суперфосфат в промышленности получают по схеме
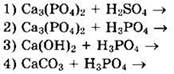
Тесты с выбором ответа для самостоятельного решения
11. Раствор хлорида цинка реагирует с
1) магнием
2) серебром
3) оловом
4) железом
12. Раствор сульфата натрия реагирует с раствором
1) СuСl2
2) MgCl2
3) ВаСl2
4) КОН
13. Растворы кислых солей могут иметь реакцию среды
1) только кислую
2) только щелочную
3) только нейтральную
4) различную
14. Осадок и газ образуются при кипячении раствора
1) СаСO3
2) Са(НСO3)2
3) NaHCO3
4) Na2CO3
15. Азот образуется при термическом разложении
1) NH4Cl
2) NH4Br
3) NH4NO2
4) (NH4)2CO3
16. И с гидроксидом натрия, и с соляной кислотой реагирует
![]()
17. Реагируют друг с другом в водном растворе
![]()
18. Сульфат меди(II) реагирует в водном растворе с каждым из двух перечисленных веществ
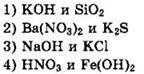
19. При взаимодействии Na2[Zn(OH)4] в водном растворе с избытком соляной кислоты образуются
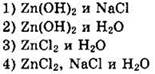
20. Временную жесткость воды можно устранить по схеме
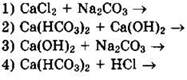
Тесты с кратким ответом с решениями
21. Установите соответствие между веществами, вступающими в реакцию, и продуктами их взаимодействия.
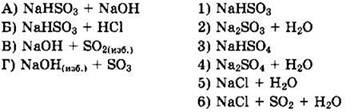
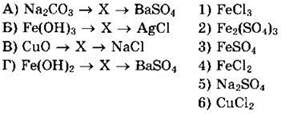
22. Установите соответствие между схемой реакции и веществом X в этой схеме.
Тесты с кратким ответом для самостоятельного решения
23. Карбонат кальция СаСO3 реагирует в водном растворе с веществами, формулы которых: 1) СO2, 2) NaOH, 3) СН3СООН, 4) CuSO4, 5) NaCl, 6) HNO3. (Запишите цифры в порядке возрастания.)
24. Хлорид меди(II) реагирует в водном растворе с веществами, формулы которых: 1) Na2SO4, 2) AgNO3, 3) КОН, 4) Hg, 5) K2S, 6) Al(NO3)3. (Запишите цифры в порядке возрастания.)
Ответы на тесты раздела 2.7
1. 2 2. 4 3. 3 4. 2 5. 4 6. 1 7. 2 8. 3 9. 1 10. 2 11. 1 12. 3 13. 4 14. 2 15. 3 16. 1 17. 4 18. 2 19. 4 20. 2 21. 2614 22. 5163 23. 136 24. 235
Решения тестов раздела 2.7
Решение 1. Металл взаимодействует с раствором соли, если этот металл активнее, то есть располагается левее в ряду напряжений, чем металл, образующий соль. Так, свинец из раствора нитрата свинца(II) может быть вытеснен металлом, который более активен, чем свинец. Используя ряд напряжений металлов, находим, что таким металлом является только цинк.
Ответ: 2.
Решение 2. Раствор соли взаимодействует с раствором кислоты, основания или другой соли, если в ходе обменной реакции образуется осадок, газ, слабый электролит или комплексное соединение. Этому условию отвечает только реакция раствора хлорида натрия с нитратом серебра: ![]()
![]()
Ответ: 4.
Решение 3. Средние соли, образованные сильным основанием и слабой кислотой, имеют вследствие гидролиза аниона щелочную среду. Кислые соли, образованные сильным основанием и слабой кислотой, могут иметь как щелочную среду вследствие гидролиза аниона, так и кислую среду вследствие диссоциации аниона. Так, гидрокарбонат-ион участвует одновременно в двух реакциях: ![]()
![]() Для определения того, какой из этих двух процессов протекает в большей степени, необходимы знание величин констант диссоциации слабых электролитов и умение определять константы гидролиза ионов. Поскольку эти понятия в школе не изучаются, следует запомнить, что все приведенные в задании соли имеют щелочную среду и только КН2РO4 имеет кислую среду.
Для определения того, какой из этих двух процессов протекает в большей степени, необходимы знание величин констант диссоциации слабых электролитов и умение определять константы гидролиза ионов. Поскольку эти понятия в школе не изучаются, следует запомнить, что все приведенные в задании соли имеют щелочную среду и только КН2РO4 имеет кислую среду.
Ответ: 3.
Решение 4. Соли аммония термически неустойчивы. При их прокаливании образуются аммиак и соответствующая кислота: ![]() Если образующая соль кислота термически неустойчива, то образуются соответствующий кислоте оксид и вода:
Если образующая соль кислота термически неустойчива, то образуются соответствующий кислоте оксид и вода: ![]() При прокаливании солей аммония могут протекать окислительно-восстановительные процессы:
При прокаливании солей аммония могут протекать окислительно-восстановительные процессы: ![]()
Напишем уравнения реакций термического разложения приведенных в задании солей:
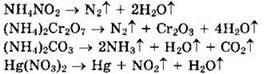
Твердый остаток — это Cr2O3.
Ответ: 2.
Решение 5. Характер термического разложения нитратов определяется активностью металла, образующего соль. Нитраты металлов, находящихся в ряду напряжений левее магния, разлагаются до нитритов и кислорода: ![]()
![]() Нитраты металлов, находящихся в ряду напряжений от магния до меди, разлагаются до оксидов металлов, оксида азота(IV) и кислорода:
Нитраты металлов, находящихся в ряду напряжений от магния до меди, разлагаются до оксидов металлов, оксида азота(IV) и кислорода: ![]()
![]() Нитраты металлов, находящихся в ряду напряжений правее меди, разлагаются до металлов, оксида азота(IV) и кислорода:
Нитраты металлов, находящихся в ряду напряжений правее меди, разлагаются до металлов, оксида азота(IV) и кислорода: ![]()
Напишем уравнения реакций термического разложения приведенных в задании солей:
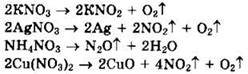
Оксид металла — CuO.
Ответ: 4.
Решение 6. Сильная кислота вытесняет из соли слабую кислоту. Сильное основание вытесняет из соли слабое основание. Поэтому и с разбавленной серной кислотой, и с гидроксидом калия будет реагировать соль, образованная слабым основанием и слабой кислотой. Такой солью является нитрит аммония:
![]()
Ответ: 1.
Решение 7. Реакция Cu(NO3)2 с Ag не идет, поскольку серебро менее активно, чем медь. Реакции K2S с NaOH и АlСl3 с H2SO4 не идут, поскольку в ходе этих реакций не образуется осадок, газ или слабый электролит. В ряду галогенов F2 - Сl2 - Вr2 - I2 более активный галоген вытесняет менее активный галоген из соответствующего галогенид- иона. Поэтому идет реакция: 2KBr + Сl2= КСl + Вr2.
Ответ: 2.
Решение 8. Растворимые соли реагируют с сильными электролитами (основаниями, кислотами или солями), если в ходе этой реакции образуется осадок, газ, слабый электролит или комплексное соединение. Хлорид железа(III) не реагирует с растворами HNO3, H2SO4 и KNO3, поэтому ответы 1, 2 и 4 не подходят. Идут реакции:
![]()
Ответ: 3.
Решение 9. При добавлении к раствору хлорида алюминия раствора гидроксида натрия вначале образуется осадок гидроксида алюминия:
![]()
При дальнейшем прибавлении раствора гидроксида натрия осадок гидроксида алюминия растворяется с образованием раствора комплексной соли:
![]()
Реакция взаимодействия хлорида алюминия с избытком гидроксида натрия:
![]()
Ответ: 1.
Решение 10. Простой суперфосфат Ca(H2PО4)2 ∙ 2CaSО4в промышленности получают действием серной кислоты на фосфат кальция: ![]()
Двойной суперфосфат Са(Н2РO4)2 в промышленности получают действием фосфорной кислоты на фосфат кальция: ![]()
Ответ: 2.
Решение 21. Напишем уравнения реакций, установим соответствие:
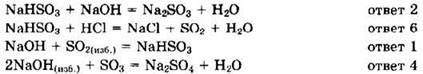
Ответ: 2614.
Решение 22. В схеме А вещество X должно содержать те же ионы Na+, СО32-, Ва2+, SO42-, которые содержатся в Na2CO3 и BaSO4. Видно, что веществ с ионами Ва2+ или СO32- среди возможных ответов нет. Вещество X — это Na2SO4. Ответ 5. Запишем возможные уравнения реакций:
![]()
В схеме Б вещество X может содержать ионы: Fe3+, ОН-, Ag+, Сl-. Среди возможных ответов веществ с ионами Ag+ или ОН- нет. Вещество X — это FeCl3. Ответ 1. Запишем возможные уравнения реакций:
![]()
В схеме В вещество X — это СuСl2. Ответ 6. Запишем возможные уравнения реакций:
![]()
В схеме Г вещество X — это FeSO4. Ответ 3. Запишем возможные уравнения реакций:
![]()
Ответ: 5163.