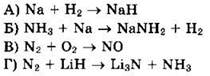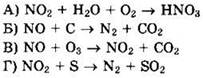Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее - Химическая реакция - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Укажите уравнение окислительно-восстановительной реакции.
2. Какие из приведенных утверждений верны? А. Степень окисления — это условный заряд атома в молекуле. Б. Восстановление — это процесс отдачи электронов.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
3. Водород Н2
1) имеет только окислительные свойства
2) имеет только восстановительные свойства
3) имеет и окислительные, и восстановительные свойства
4) не имеет таких свойств
4. Имеет и окислительные, и восстановительные свойства
1) НСl
2) Na2S
3) К2Сr2O7
4) Сu
5. Укажите схему, которой соответствует процесс окисления.
![]()
6. В какой реакции хлор проявляет и окислительные, и восстановительные свойства?
![]()
7. В уравнении реакции железа с соляной кислотой коэффициент перед формулой окислителя равен
1) 1
2) 2
3) 3
4) 4
8. В реакции FeO + СО = Fe + СO2 происходит
1) восстановление С+2
2) окисление Fe°
3) восстановление Fe+2
4) окисление О-2
9. Наиболее активно коррозирует
1) техническое железо
2) химически чистое железо
3) железо, покрытое слоем олова
4) сплав железа с хромом и никелем
10. В алюминиевом изделии предпочтительно использовать заклепки из
1) золота
2) алюминия
3) магния
4) железа
Тесты с выбором ответа для самостоятельного решения
11. Укажите уравнение реакции, которая не является окислительно-восстановительной.
12. Какие из приведенных утверждений верны? А. Окисление — это процесс отдачи электронов. Б. Окислитель — это атом, молекула или ион, который принимает электроны.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
13. Фтор F2 может быть
1) только окислителем
2) только восстановителем
3) и окислителем, и восстановителем
4) не имеет таких свойств
14. Имеет только окислительные свойства
1) Mg
2) SO2
3) HNO2
4) KMnO4
15. Укажите схему, которой соответствует процесс восстановления.
![]()
16. В какой реакции водород проявляет окислительные свойства?
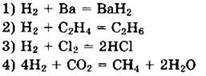
17. В уравнении реакции железа с хлором коэффициент перед формулой окислителя равен
1) 1
2) 2
3) 3
4) 4
18. В реакции CuSO4 + Fe = FeSO4 + Сu происходит
1) окисление Сu+2
2) окисление Fe°
3) восстановление S+6
4) восстановление О-2
19. Электрохимическую коррозию металла вызывает
1) контакт металла и кислорода
2) контакт металла с оксидами углерода и серы
3) наличие примесей в металле, контакт с другими металлами
4) контакт металла с водой
20. При лужении железа оно покрывается тонким слоем
1) меди
2) цинка
3) никеля
4) олова
Тесты с кратким ответом с решениями
21. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
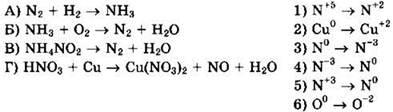
22. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
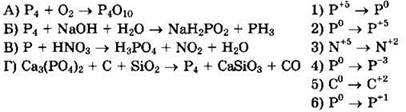
23. Установите соответствие между схемой реакции и названием восстановителя в ней.
|
|
1) гидрид лития 2) водород 3) натрий 4) аммиак 5) азот 6) кислород |
24. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции ![]()
![]()
|
А) NO Б) NaOH В) N2 Г) Н2O |
1) 1 2) 2 3) 3 4) 4 5) 5 6) 6 |
25. Установите соответствие между исходными веществами окислительно-восстановительных реакций и продуктами их взаимодействия.
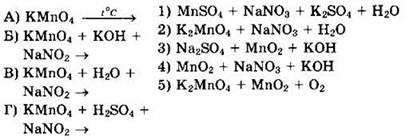
Тесты с кратким ответом для самостоятельного решения
26. Установите соответствие между схемой реакции и из- мецением степени окисления окислителя.
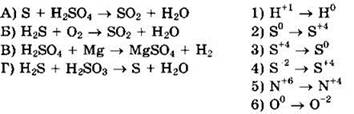
27. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
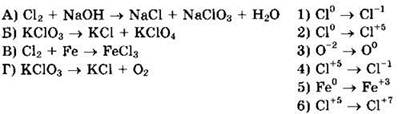
28. Установите соответствие между схемой реакции и названием окислителя в ней.
|
|
1) оксид азота(II) 2) углерод 3) сера 4) кислород 5) оксид азота(IV) 6) озон |
29. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции ![]()
![]()
|
A) HNO3 |
1) 7 |
|
Б) Cu(NO3)2 |
2) 3 |
|
В) NO |
3) 2 |
|
Г) Н2O |
4) 6 |
|
5) 8 |
|
|
6) 4 |
30. Установите соответствие между исходными веществами окислительно-восстановительных реакций и продуктами их взаимодействия.
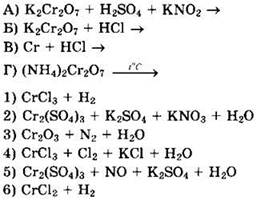
Тесты с полным ответом с решениями
31. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
32. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
33. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
34. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
35. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
36. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
37. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
38. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
39. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
40. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
41. Напишите продукты реакции, поставьте коэффициенты. Укажите коэффициент перед восстановителем:
![]()
42. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
43. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
44. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
45. Используя метод электронного баланса, составьте уравнение реакции:
![]()
46. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
47. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
48. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
49. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
50. Используя метод электронного баланса, составьте уравнение реакции:
![]()
Определите окислитель и восстановитель.
Ответы на тесты раздела 1.4.8
1. 4 2. 1 3. 3 4. 1 5. 4 6. 3 7. 2 8. 3 9. 1 10. 2 11. 2 12. 3 13. 1 14. 4 15. 4 16. 1 17. 3 18. 2 19. 3 20. 4 21. 3651 22. 2625 23. 3351 24. 6412 25. 5241 26. 5613 27. 2653 28. 4165 29. 5236 30. 2463
Решения тестов раздела 1.4.8
Решение 1. Окислительно-восстановительные реакции — реакции, которые идут с изменением степеней окисления элементов. В простых веществах степень окисления атомов равна нулю, в сложных веществах, как правило, отличается от нуля. Поэтому реакции замещения являются окислительно-восстановительными реакциями. Такой реакцией является реакция железа с серной кислотой, в которой железо переходит от Fe0 к Fe2+, а водород переходит от Н+ к Н0.
Ответ: 4.
Решение 2. Степень окисления — условный заряд атома в молекуле, где полярные связи считаются ионными. Утверждение А верно. Окисление — это процесс отдачи электронов. Восстановление — это процесс присоединения электронов. Окислитель — это атом, молекула или ион, который принимает электроны. Восстановитель — это атом, молекула или ион, который отдает электроны. Утверждение В неверно.
Ответ: 1.
Решение 3. Водород в свободном состоянии имеет степень окисления, равную нулю. Зная электронную формулу водорода в Н2 - 1s1, можно утверждать, что водород может также иметь высшую степень окисления +1 (1s0) и низшую степень окисления -1 (1s2). Элемент в высшей степени окисления, когда отданы все валентные электроны, может быть только окислителем: Mn+7, S+6, N+5 и др. Элемент в низшей степени окисления, когда внешняя оболочка полностью заполнена электронами, может быть только восстановителем: Na0, Al0, N-3, S-2, I-1 и др. В промежуточных степенях окисления элемент может иметь и окислительные, и восстановительные свойства: S0, Н0, N+3, О-1, S+4 и др. Таким образом, водород Н2 находится в промежуточной степени окисления и может иметь как окислительные свойства (Н2 + 2Na = 2NaH), так и восстановительные свойства (Н2 + Сl2 = 2НСl).
Ответ: 3.
Решение 4. В сульфиде натрия сульфид-ион S2- имеет только восстановительные свойства, ион Na+, хотя и находится в высшей степени окисления, практически окислительных свойств не имеет, и процесс получения натрия идет лишь в ходе электролиза расплава соли. Для дихромата калия, где хром находится в высшей степени окисления, характерны только окислительные свойства. Для меди характерны только восстановительные свойства.
В хлороводороде водород имеет высшую степень окисления +1 и может быть только окислителем, а хлор имеет низшую степень окисления -1 и может быть только восстановителем. Таким образом, хлороводород может иметь и окислительные, и восстановительные свойства:
2НСl + Mg = MgCl2 + Н2
НСl — окислитель, Mg — восстановитель
4НСl + МnO2 = МnСl2 + Сl2 + 2Н2O
НСl — восстановитель, МnO2 — окислитель
Ответ: 1.
Решение 5. Окисление — это процесс отдачи электронов. Определим степени серы в соединениях и ионах, перечисленных в задании, и напишем соответствующие полуреакции. Для ![]() имеем
имеем ![]() — это не окислительно-восстановительная реакция. Для
— это не окислительно-восстановительная реакция. Для ![]() имеем
имеем ![]() — это процесс восстановления. Для
— это процесс восстановления. Для ![]() имеем
имеем ![]() — это процесс восстановления. Для
— это процесс восстановления. Для ![]() имеем
имеем ![]() — это процесс окисления.
— это процесс окисления.
Ответ: 4.
Решение 6. Окислитель — это атом, молекула или ион, который принимает электроны. Определим степени окисления хлора в перечисленных в задании реакциях. В реакции с фтором хлор отдает электроны: ![]() и является восстановителем. В реакциях с железом и метаном хлор принимает электроны:
и является восстановителем. В реакциях с железом и метаном хлор принимает электроны: ![]() и является окислителем. В реакции с водой хлор Сl2(Сl0) проявляет как окислительные свойства, переходя в НСl (Сl-1), так и восстановительные свойства, переходя в НСlO (Сl+1). Такие реакции называют реакциями диспропорционирования.
и является окислителем. В реакции с водой хлор Сl2(Сl0) проявляет как окислительные свойства, переходя в НСl (Сl-1), так и восстановительные свойства, переходя в НСlO (Сl+1). Такие реакции называют реакциями диспропорционирования.
Ответ: 3.
Решение 7. Железо, реагируя с обычными кислотами, образует соли Fe+2. Железо, реагируя с HNO3 разб. или при нагревании с HNO3 конц. и с H2SO4 конц., образует соли Fe+3. Напишем уравнение реакции:
![]()
![]() Fe — восстановитель
Fe — восстановитель
![]() НСl — окислитель
НСl — окислитель
Коэффициент перед окислителем НСl равен 2.
Ответ: 2.
Решение 8. Напишем полуреакции для реакции FeO + СО = Fe + СO2:
![]() процесс восстановления Fe+2
процесс восстановления Fe+2
![]() процесс окисления С+2
процесс окисления С+2
В реакции идет восстановление ионов Fe+2.
Ответ: 3.
Решение 9. Коррозия металла — разрушение металла под действием окружающей среды: кислорода воздуха, воды и др. Электрохимическая коррозия — это разрушение металла, находящегося в контакте с менее активным металлом, под действием окружающей среды. Техническое железо содержит примеси других металлов. Поэтому это железо вследствие электрохимической коррозии будет коррозировать более активно, чем химически чистое железо. Железо, покрытое оловом (луженое железо), и сплав железа с хромом и никелем (нержавеющее железо) коррозируют еще в меньшей степени, чем химически чистое железо.
Ответ: 1.
Решение 10. Если металл находится в контакте с менее активным металлом, то он коррозирует более активно по сравнению с коррозией одного этого же металла. Если металл находится в контакте с более активным металлом, то он коррозирует гораздо в меньшей степени по сравнению с коррозией одного этого же металла. Для защиты изделий из железа к ним прикрепляют более активные металлы (магний и др.). Такой способ защиты металла от коррозии называют протекторной защитой.
Если изделие из алюминия скреплять заклепками из менее активных металлов — золота или железа, то алюминий вблизи заклепок будет быстро коррозировать, что приведет к разрушению изделия. Если изделие из алюминия скреплять заклепками из более активных металлов — магния, материал этих заклепок будет быстро коррозировать, что также приведет к разрушению изделия. Изделия из алюминия следует скреплять заклепками из алюминия. В этом случае электрохимическая коррозия не возникает.
Ответ: 2.
Решение 21. Для схемы реакции ![]() имеем:
имеем:
![]() окислитель N2 восстанавливается
окислитель N2 восстанавливается
![]() восстановитель Н2 окисляется, ответ 3
восстановитель Н2 окисляется, ответ 3
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель O2 восстанавливается
окислитель O2 восстанавливается
![]() восстановитель NH3 окисляется, ответ 6
восстановитель NH3 окисляется, ответ 6
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель NH4NO2 восстанавливается
окислитель NH4NO2 восстанавливается
![]() восстановитель NH4NO2 окисляется, ответ 5
восстановитель NH4NO2 окисляется, ответ 5
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель HNO3 восстанавливается
окислитель HNO3 восстанавливается
![]() восстановитель Сu окисляется, ответ 1
восстановитель Сu окисляется, ответ 1
Ответ: 3651.
Решение 22. Для схемы реакции ![]() имеем:
имеем:
![]() окислитель O2 восстанавливается
окислитель O2 восстанавливается
![]() восстановитель Р4 окисляется, ответ 2
восстановитель Р4 окисляется, ответ 2
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель Р4 восстанавливается
окислитель Р4 восстанавливается
![]() восстановитель Р4 окисляется, ответ 6
восстановитель Р4 окисляется, ответ 6
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель HNO3 восстанавливается
окислитель HNO3 восстанавливается
![]() восстановитель Р окисляется, ответ 2
восстановитель Р окисляется, ответ 2
Для схемы реакции ![]()
![]() имеем:
имеем:
![]() окислитель Са3(РO4)2 восстанавливается
окислитель Са3(РO4)2 восстанавливается
![]() восстановитель С окисляется, ответ 5
восстановитель С окисляется, ответ 5
Ответ: 2625.
Решение 23. Для схемы реакции ![]() имеем:
имеем:
![]() окислитель Н2 восстанавливается
окислитель Н2 восстанавливается
![]() восстановитель Na окисляется, ответ 3
восстановитель Na окисляется, ответ 3
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель NH3 восстанавливается
окислитель NH3 восстанавливается
![]() восстановитель Na окисляется, ответ 3
восстановитель Na окисляется, ответ 3
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель O2 восстанавливается
окислитель O2 восстанавливается
![]() восстановитель N2 окисляется, ответ 5
восстановитель N2 окисляется, ответ 5
Для схемы реакции ![]() имеем:
имеем:
![]() окислитель N2 восстанавливается
окислитель N2 восстанавливается
![]() восстановитель LiH окисляется, ответ 1
восстановитель LiH окисляется, ответ 1
Ответ: 3351.
Решение 24. Для схемы реакции ![]()
![]() имеем:
имеем:
![]() окислитель NO восстанавливается
окислитель NO восстанавливается
![]() восстановитель NO окисляется
восстановитель NO окисляется
Используя полученные полуреакции, ставим коэффициенты в уравнении реакции и устанавливаем соответствие.
![]()
Ответ: 6412.
Решение 25. В перманганате калия КМnО4 марганец находится в высшей степени окисления Мn+7 и имеет только окислительные свойства, восстанавливаясь в кислой среде до солей Мn+2, в нейтральной среде — до осадка МnO2, а в щелочной среде — до манганатов, например К2МnO4. Нитрит натрия NaNO2, в котором азот имеет промежуточную степень окисления N+3, может иметь как окислительные, так и восстановительные свойства. Реагируя с окислителем КМnO4, нитрит натрия NaNO2 проявляет восстановительные свойства и окисляется до NaNO3. При термическом разложении перманганата калия КМnO4 образуются манганат калия К2МnO4, оксид марганца(IV) МnO2 и кислород O2. Это позволяет написать схемы требуемых уравнений и установить соответствие.
![]()
Ответ 5.
![]()
Ответ 2.
![]()
Ответ 4.
![]()
Ответ: 1.
Ответ: 5241.
Решение 31. Для написания реагентов и продуктов в окислительно-восстановительных реакциях следует знать некоторые окислители и восстановители, а также продукты, в которые эти вещества переходят.
|
Окислители |
Восстановители |
|
(принимают электроны) |
(отдают электроны) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Используя эту таблицу, можно увидеть, что переход из СrСl3 в Na2CrO4 идет в щелочной среде, поэтому в левую часть уравнения следует добавить гидроксид натрия NaOH. Видно, что хлор Сl2должен переходить в хлорид-ион. Поэтому среди продуктов, учитывая наличие гидроксида натрия, следует написать хлорид натрия. Кроме того, необходимо добавить воду. Получаем:
![]()
Согласно методу электронного баланса число отданных электронов равно числу принятых электронов. Записываем полуреакции и домножаем их так, чтобы число отданных электронов стало равным числу принятых электронов:
![]()
Ставим полученные коэффициенты в уравнение реакции, получая:
![]()
Указываем: Сr+3 или СrСl3 — это восстановитель, а Сl0 или Сl2 — это окислитель.
Решение 32. Кислоты по их взаимодействию с металлами можно разделить на две группы: обычные кислоты (НСl, H2SO4 разб. и др.) и кислоты-окислители (HNO3 И H2SO4 конц.).
В обычных кислотах в ходе их реакции с металлами электроны принимают ион Н+, при этом выделяется водород Н2. С обычными кислотами реагируют металлы, находящиеся в ряду напряжений до водорода.
![]() Zn до Н2 в ряду напряжений
Zn до Н2 в ряду напряжений
Сu + НСl ≠ Сu после Н2 в ряду напряжений
![]() Fe дает соли Fe(II)
Fe дает соли Fe(II)
Кислоты-окислители (HNO3 и H2SO4 (конц.)) не реагируют с Аu и Pt. Концентрированные азотная и серная кислоты пассивируют на холоде железо, алюминий и хром. Эти кислоты, реагируя с металлами, образуют соль, воду и один или несколько из ниже перечисленных продуктов в зависимости от концентрации кислоты и активности металлов. Неметаллы образуют с кислотами-окислителями соответствующие неметаллам кислоты, воду и те же продукты, что и тяжелые металлы. Образующиеся продукты перечислены в таблице. Эти записи условны, поскольку одновременно могут выделяться несколько продуктов.
|
Кислота |
Металлы |
Продукт |
|
HNO3конц. |
тяжелые |
N+4— NO2 |
|
HNO3разб. |
тяжелые |
N+2— NO |
|
HNO3конц. |
активные |
N+1 — N2O |
|
HNO3разб. |
активные |
N0 — N2 |
|
HNO3оч. разб. |
активные |
N-3 — NH4NO3 |
|
H2SO4конц. |
тяжелые |
S+4 — SO2 |
|
H2SO4конц. |
активные |
S0 — S |
|
H2SO4конц. |
очень активные |
S-2 — H2S |
В задании продукт (H2S) дан, надо написать лишь соль — нитрат цинка — и воду. Имеем:
![]()
Расставляем коэффициенты методом электронного баланса.
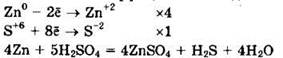
Цинк (Zn0) — восстановитель, серная кислота (S+6) — окислитель.
Решение 33. Как уже отмечалось, азотная кислота окисляет неметаллы до соответствующих высших кислот. Кроме того, образуются продукт восстановления азотной кислоты и вода. Образование NO2 указывает, что сера реагировала с концентрированной азотной кислотой. Поэтому в предложенном уравнении продуктами будут серная кислота и вода:
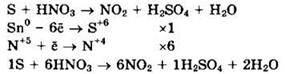
Сера (S0) — восстановитель, азотная кислота (N+5) — окислитель.
Решение 34. Образование хромата калия указывает, что реакция шла в щелочной среде, а именно в присутствии гидроксида калия КОН, поскольку в кислой среде образовался бы дихромат калия. В щелочной среде перманганат калия восстанавливается до манганата калия К2МnO4. Имеем:
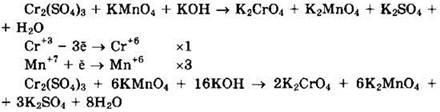
Сульфат хрома(III) (Сr+3) — восстановитель, перманганат калия (Мn+7) — окислитель.
Решение 35. Образование MnSO4 из перманганата указывает, что реакция шла в сернокислой среде, поэтому среди продуктов надо добавить H2SO4. Среди продуктов записываем NaNO3, K2SO4и Н2O. Имеем:
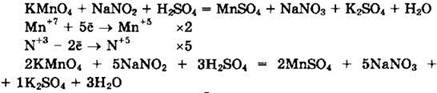
Перманганат калия (Mn+7) — окислитель, нитрит натрия (N+3) — восстановитель.
Решение 36. Видно, что сульфит натрия переходит в сульфат натрия и является восстановителем. Значит, иод является окислителем и переходит в иодид-ион. Если в левую часть уравнения поместить гидроксид натрия, то в правой части следует поместить иодид натрия. Имеем:
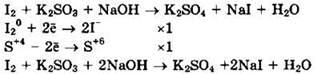
Иод (I20) — окислитель, сульфит натрия (S+4) — восстановитель.
Решение 37. Сульфат железа(II) переходит в феррат калия и является восстановителем. Хлорат калия является окислителем и переходит в хлорид калия. В левую часть уравнения помещаем гидроксид калия, поскольку в правой части уравнения появляются ионы калия. В правую часть уравнения помещаем хлорид калия и воду. Имеем:
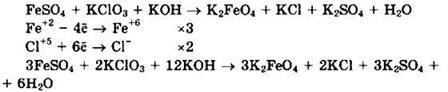
Сульфат железа(II) (Fe+2) — восстановитель, хлорат калия (Сl+5) — окислитель.
Решение 38. Оксид хрома(III) переходит в хромат калия и является восстановителем. Нитрит натрия может быть получен из нитрата калия. Поэтому в левую часть уравнения помещаем нитрат калия, а в правую часть уравнения помещаем воду. Имеем:
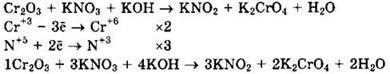
Оксид хрома(III) (Сr+3) — восстановитель, нитрат калия (N+5) — окислитель.
Решение 39. Сульфит натрия Na2SO3 является восстановителем и переходит в сульфат натрия, который следует записать в правой части уравнения. Наличие сульфата калия в правой части уравнения указывает, во-первых, на наличие в левой части уравнения серной кислоты, а во-вторых, на то, что йодат калия КIO3, являясь окислителем, восстанавливается до молекулярного иода, а не до иодида калия. Имеем:
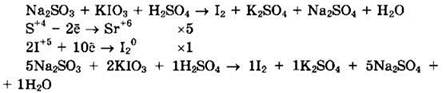
Сульфит натрия (S+4) — восстановитель, а йодат калия (I+5) — окислитель.
Решение 40. Дихромат калия восстанавливается до гидроксида хрома(III). Сульфат натрия может быть получен окислением сульфита натрия, который следует написать в левой части уравнения реакции. Учитывая то, что в правой части уравнения должны быть ионы калия, а среда щелочная, на что указывает наличие осадка Cr(OH)3↓, то там следует написать гидроксид калия. Имеем:
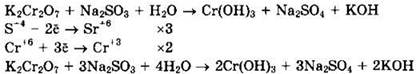
Дихромат калия (Сr+6) — окислитель, сульфит натрия (S+4) — восстановитель.
Решение 41. ![]()
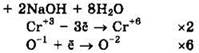
Восстановитель — Na3[Cr(OH)6] или Сr+3, окислитель — H2O2 или О-1.
Решение 42. ![]()
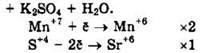
Восстановитель — K2SO3 или S+4, окислитель — KMnO4 или Mn+7.
Решение 43. ![]()
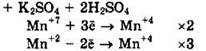
Восстановитель — MnSO4 или Mn+2, окислитель — KMnO4 или Mn+7.
Решение 44. ![]()
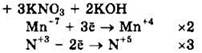
Восстановитель — KNO2 или N+3, окислитель — KMnO4 или Mn+7.
Решение 45. ![]()
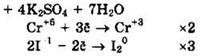
Восстановитель — KI или I-1, окислитель — K2Cr2O7 или Сr+6.
Решение 46. ![]()
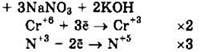
Восстановитель — NaNO2 или N+a, окислитель — К2Сr2O7 или Сr+6.
Решение 47. ![]()
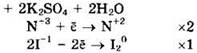
Восстановитель — KI или I-1, окислитель — KNO2 или N+3.
Решение 48. ![]()
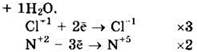
Восстановитель — NO или N+2, окислитель — КСlO или Сl+1.
Решение 49. ![]()
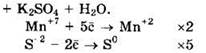
Восстановитель — H2S или S-2, окислитель — KMnO4 или Mn+7.
Решение 50. ![]()
![]()
Восстановитель — P0, окислитель — HNO3 или N+5.