Химия ЕГЭ - 1000 заданий с ответами и решениями - 2018 год
Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты - Химическая реакция - ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Тесты с выбором ответа с решениями
1. Электролитом является
1) метаналь
2) метил ацетат
3) октан
4) ацетат аммония
2. Неэлектролитом является каждое из двух веществ
1) метанол и соляная кислота
2) глюкоза и этилацетат
3) бензол и гидроксид натрия
4) толуол и нитрат калия
3. Причина электролитической диссоциации вещества
1) пропускание постоянного электрического тока
2) пропускание переменного электрического тока
3) взаимодействие вещества с молекулами растворителя
4) взаимодействие молекул вещества между собой
4. Определите степень диссоциации соединения АВ, если в растворе в равновесии одновременно присутствуют: 10А+, 10В- и 40 АВ.
1) 0,20
2) 0,25
3) 0,33
4) 0,50
5. Слабый электролит — это
1) НNO2
2) НВr
3) HNO3
4) НМnO4
6. Формула слабого и сильного электролита соответственно
![]()
7. Сила электролитов постоянно возрастает в ряду
![]()
8. Число стадий диссоциации Al2(SO4)3равно
1) 4
2) 3
3) 2
4) 1
9. Электролиты, образующие при диссоциации в качестве анионов только гидроксид-анионы,
1) основания
2) соли
3) кислоты
4) оксиды
10. Какое вещество продиссоциировало, если из 1 моль вещества образовалось 3 моль-ионов?
![]()
Тесты с выбором ответа для самостоятельного решения
11. Неэлектролит — это
1) гидроксид калия
2) иодид калия
3) азотная кислота
4) сахароза
12. Электролитом является каждое из двух веществ
1) пропанол-2 и сульфат натрия
2) уксусная кислота и хлорид метиламмония
3) муравьиная кислота и фруктоза
4) фенол и диметиловый эфир
13. Сильный электролит — это
1) СН3СООН
2) HNO2
3) НСlO4
4) Н3РO4
14. При разбавлении раствора слабого электролита степень его диссоциации
1) увеличивается
2) уменьшается
3) не меняется
4) уменьшается незначительно
15. Число стадий диссоциации Н2СО3 равно
1) 1
2) 2
3) 3
4) 4
16. Неэлектролитом является каждое из двух веществ
1) этилацетат и глюкоза
2) бензол и ацетат калия
3) толуол и фенолят натрия
4) хлорид калия и гидроксид натрия
17. Электролиты, образующие при диссоциации в качестве катионов только катионы водорода, — это
1) основания
2) соли
3) кислоты
4) оксиды
18. Электролиты расположены в порядке увеличения степени диссоциации в ряду
![]()
19. Какое вещество продиссоциировало, если из 1 моль вещества образовалось 4 моль ионов?
![]()
20. Формулы двух слабых электролитов
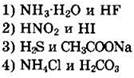
Ответы на тесты раздела 1.4.5
1. 4 2. 2 3. 3 4. 1 5. 1 6. 2 7. 2 8. 4 9. 1 10. 3 11. 4 12. 2 13. 3 14. 1 15. 2 16. 1 17. 3 18. 4 19. 4 20. 1
Решения тестов раздела 1.4.5
Решение 1. Электролиты — это вещества, растворы или расплавы которых проводят электрический ток. Электролитами являются соли, основания и кислоты. Большинство органических веществ электролитами не являются. Перечисленные в задании органические вещества: метаналь, метилацетат и октан — электролитами не являются, а ацетат натрия (соль) является электролитом.
Ответ: 4.
Решение 2. Неэлектролиты — вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относится большинство органических веществ. Среди органических веществ к электролитам в первую очередь относятся кислоты и основания, а также их соли. Электролитами являются, например, уксусная кислота СН3СООН, ацетат натрия CH3COONa, хлорид метиламмония CH3NH3Cl, бензойная кислота С6Н5СООН и фенолят натрия C6H5ONa. Поскольку перечисленные в заданиях соляная кислота, гидроксид натрия и нитрат калия являются электролитами, то соответствующие ответы не подходят. Неэлектролитами являются углевод глюкоза С6Н12О6 и сложный эфир этилацетат СН3СООС2Н5.
Ответ: 2.
Решение 3. Электролитическая диссоциация — распад электролита на катионы и анионы под действием полярных молекул растворителя. Ионные кристаллы (щелочи, растворимые соли) при растворении в воде переходят в раствор в виде гидратированных ионов, таким образом, процесс диссоциации для них совпадает с процессом растворения. Полярные молекулы (кислоты) при растворении в воде вначале поляризуются до образования ионных молекул, которые затем диссоциируют на ионы, но часть полярных молекул может находиться в растворе в недиссоциированном виде. Причина электролитической диссоциации — во взаимодействии электролита с полярными молекулами растворителя. Электрический ток служит для обнаружения ионов в растворе: чем больше ионов в растворе, тем легче через раствор проходит электрический ток.
Ответ: 3.
Решение 4. Степень диссоциации (α) — отношение числа диссоциированных молекул (N) к общему числу молекул в растворе (N0): α = N/N0. Если α = 0, то нет диссоциации, если α = 1, то полная диссоциация, если 0 < α < 1, то частичная диссоциация. Чем больше степень диссоциации, тем в большей степени диссоциировано соединение. Из уравнения реакции диссоциации: ![]() видно, что раз в растворе находятся 10А+ и 10В-, то число диссоциированных молекул N = 10. Поскольку в растворе имеется 40 недиссоциированных молекул, то общее число молекул в растворе равно N0 = 10 + 40 = 50. Отсюда находим степень диссоциации вещества: α = N/N0 = 10/50 = 0,20.
видно, что раз в растворе находятся 10А+ и 10В-, то число диссоциированных молекул N = 10. Поскольку в растворе имеется 40 недиссоциированных молекул, то общее число молекул в растворе равно N0 = 10 + 40 = 50. Отсюда находим степень диссоциации вещества: α = N/N0 = 10/50 = 0,20.
Ответ: 1.
Решение 5. Сильными электролитами, то есть соединениями, которые практически полностью диссоциированы на ионы, являются: соли, щелочи, некоторые кислоты: HNO3, НСl, H2SO4, HBr, HI, НМnO4, НСlO4 и др.
Слабыми электролитами, то есть соединениями, которые лишь в незначительной степени диссоциированы на ионы, являются: вода, нерастворимые основания и гидрат аммиака NH3H2O, многие кислоты: HNO2, HF, H2SO3, Н3РO4, Н2СO3, H2S, СН3СООН и др.
Среди перечисленных в задании соединений слабым электролитом является HNO2, a HBr, HNO3 и НМnO4 являются сильными электролитами.
Ответ: 1.
Решение 6. Определяем силу перечисленных в задании электролитов: H2SO4 — сильный, H2S — слабый; Н2O — слабый, NH4Cl — сильный; HNO3 — сильный, НСlO4 — сильный; СН3СООН — слабый, НСООН — слабый.
Ответ: 2.
Решение 7. Сила высших кислот возрастает с увеличением неметаллических свойств элемента, образующего кислоту. Так, сила кислот растет в рядах: H2SiO3 < Н3РO4 < H2SO4 < НСlO4; H2SiO3< Н2СO3; Н3РO4 < HNO3. Сила кислородных кислот возрастает с увеличением степени окисления элемента, образующего кислоту. Так, сила кислот возрастает в рядах: НСlO < НСlO2 < НСlO3 < НСlO4; HNO2 < HNO3; H2SO3 < H2SO4. Сила кислот возрастает с поляризуемостью (а значит, с объемом) молекул. Так, сила кислот возрастает в ряду: HF < НСl < HBr < HI.
В ряду HNO3, Н2СО3, Н3ВО3 сила электролитов постоянно ослабевает. В ряду Н3РO4, H2SO4, НСlO4 сила электролитов постоянно возрастает. В ряду Н2СO3, H2SiO3, Н3РO4 сила электролитов сначала ослабевает, потом возрастает. В ряду HI, HF, НСl сила электролитов сначала ослабевает, потом возрастает.
Ответ: 2.
Решение 8. Двухосновные или трехосновные слабые кислоты, а также двукислотные или трехкислотные слабые основания диссоциируют ступенчато:
![]()
при этом диссоциация по второй ступени идет еще в меньшей степени, чем по первой.
Сильные электролиты Al2(SO4)3диссоциируют полностью в одну стадию: ![]()
Ответ: 4.
Решение 9. С точки зрения теории электролитической диссоциации имеем следующие определения. Кислоты — электролиты, образующие в качестве катионов только катионы водорода. Основания — электролиты, образующие при диссоциации в качестве анионов только гидроксид- анионы. Соли — электролиты, образующие при диссоциации катионы металла (или аммония) и анионы кислотных остатков.
Ответ: 1.
Решение 10. Перечисленные в задании соединения являются растворимыми солями, а значит, являются сильными электролитами и диссоциируют полностью в одну стадию.
Напишем уравнение диссоциации: ![]()
Видно, что из 1 моль FeCl3 образуется 1 моль Fe3+ и 3 моль Сl- , то есть всего 4 моль ионов.
Напишем уравнение диссоциации: ![]()
Видно, что из 1 моль Na3PO4 образуется 3 моль Na+ и 1 моль РO43-, то есть всего 4 моль ионов.
Напишем уравнение диссоциации: ![]()
Видно, что из 1 моль Na2SO4 образуется 2 моль Na+ и 1 моль SO42-, то есть всего 3 моль ионов.
Напишем уравнение диссоциации: ![]()
Видно, что из 1 моль CH3COONa образуется 1 моль СН3СОO- и 1 моль Na+, то есть всего 2 моль ионов.
Ответ: 3.