Настольная книга учителя по химии 9 класс - поурочные разработки
Аммиак - Неметаллы
Цели урока. Рассмотреть строение молекулы аммиака, повторив на ее примере ковалентную полярную связь. Познакомить учащихся с физическими свойствами (и на их примере с водородной связью), собиранием, распознаванием и химическими свойствами аммиака (и на их примере с донорно-акцепторным механизмом образования ковалентной связи).
Оборудование и реактивы. Нашатырный спирт (10%-ный раствор NH3), аммиачная вода, кристаллические NH4Cl и Са(ОН)2, фенолфталеин, НСl (конц.), КМnO4 (для получения O2), растворKI, крахмал, лакмусовая бумажка; кристаллизатор, прибор для получения газов, цилиндр, установка для демонстрации «фонтана» в колбе, стеклянные палочки, прибор для сжигания NH3 вO2; зажигалка для газовых плит с двумя батарейками «Марс», горелка, спички, пробирки, лабораторный штатив.
I. Строение молекулы
Учащиеся записывают электронную и структурную формулу аммиака и сами указывают тип связи:
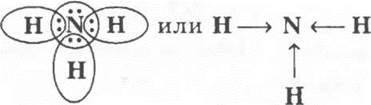
II. Свойства аммиака
Учитель демонстрирует нашатырный спирт. Учащиеся осторожно нюхают розданную им аммиачную воду.
Аммиак NH3 — газ без цвета, с резким запахом, почти в два раза легче воздуха. При охлаждении до - 33,6 °С он сжижается, а при температуре -77,8 °С превращается в твердое белое вещество. Повышая давление, аммиак можно легко перевести в жидкое состояние даже при обычной температуре, поэтому он применяется как хладоагент в холодильных установках. Это связано с возникновением между его молекулами особой химической связи — водородной. Учитель объясняет механизм образования этой связи, обратив внимание учащихся на наличие свободной электронной пары у атома азота в молекуле аммиака, наличие частичного (δ+) заряда на атоме водорода Нδ+ и наличие частичного (δ-) заряда на атоме азота Nδ-:
![]()
Учитель дает определение этой связи:
Водородной называется связь между атомами водорода одной молекулы и атомами очень электроотрицательных элементов, имеющих свободные электронные пары — F, О, N — другой молекулы.
Напоминает, что этой связью объясняется тот факт, что низкомолекулярные вещества, например вода, являются при обычных условиях жидкостями:
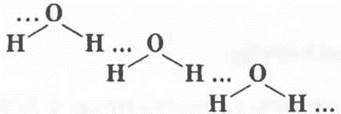
или легко сжижаются, например фтороводород:
![]()
Эта же, водородная, связь объясняет хорошую растворимость NH3 и HF в воде.
Учитель демонстрирует получение аммиака нагреванием смеси хлорида аммония с гидроксидом кальция:
![]()
и последующее растворение его в воде.
Можно показать две модификации растворения аммиака в воде:
1) наполненную аммиаком пробирку опускают в кристаллизатор с водой, в которую добавили немного фенолфталеина. Вода быстро заполняет пробирку, а раствор аммиака окрашивается в малиновый цвет (рис. 25);
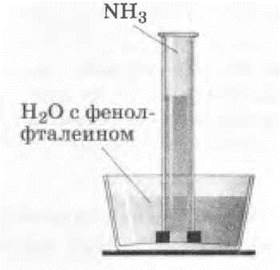
Рис. 25. Растворение аммиака в воде
2) «фонтан» в колбе (рис. 26).
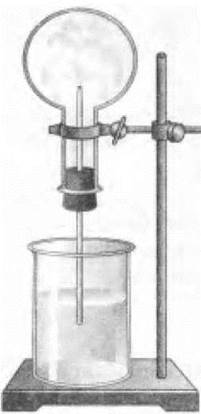
Рис. 26. Установка для демонстрации растворимости аммиака в воде: «фонтан» в колбе
Растворимость аммиака в воде, подчеркивает учитель, очень велика — в 1 объеме воды растворяется 700 объемов аммиака. Причина этого уже известна — образование водородных связей между молекулами аммиака и воды:
![]()
И это более точное отображение происходящих процессов, нежели привычное нам объяснение образования гидроксида аммония по донорно-акцепторному механизму. Теперь вместоNH4OH принято записывать формулу моногидрата аммиака NH3 · Н2O.
Образование же ионов аммония и гидроксид-ионов в аммиачной воде можно отразить уравнением:
![]()
В аммиачной воде большая часть аммиака содержится в виде молекул NH3, равновесие смещено влево, и поэтому такая вода пахнет аммиаком. (Учитель демонстрирует обесцвечивание окрашенной фенолфталеином аммиачной воды при нагревании.)
Более наглядно образование катиона аммония NH4+ по донорно-акцепторному механизму (учитель разбирает этот механизм и дает его определение в контексте учебника) рассматривается на примере образования солей аммония. При этом к молекуле аммиака по этому механизму присоединяется катион водорода Н+ из молекулы кислоты и образуется ион NH4+, в котором три ковалентные связи образуются по обменному механизму, а четвертая — по донорно-акцепторному. Тем не менее все связи равноценны (рис. 27).
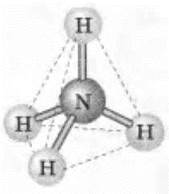
Рис. 27. Схема строения иона аммония
Учитель демонстрирует «дым без огня», поднося друг к другу две стеклянные палочки, смоченные концентрированными растворами аммиака и соляной кислоты. Между этими палочками появляется обильный белый дым (рис. 28):
![]()
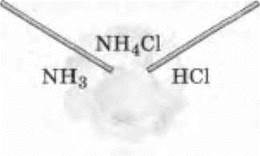
Рис. 28. Образование дыма хлорида аммония при взаимодействии аммиака с хлороводородом
Аналогично аммиак взаимодействует и с другими кислотами:
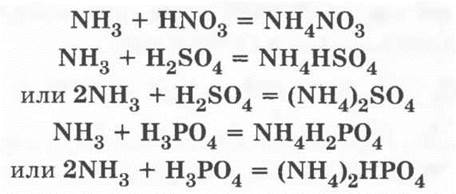
На примере этих реакций повторяются средние и кислые соли.
Итак, обобщает учитель, 1-ю группу свойств аммиака составляют свойства, в основе которых лежит образование особого иона — катиона аммония NH4+. В нем, как могут убедиться ученики, с. о. азота не изменяется — она остается равной -3. 2-я группа свойств аммиака вытекает из того, что азот в аммиаке имеет наименьшее значение степени окисления -3, т. е. он не способен к принятию электронов и может только отдавать их, проявляя при этом исключительно восстановительные свойства. Ученики сами прогнозируют, что в роли окислителя конечно же может выступать кислород.
Учитель показывает и объясняет окисление аммиака без катализатора и с его помощью.
1. В прибор, изображенный на рисунке 29, направляют по одной трубке аммиак, а по другой — кислород. К струе аммиака подносят зажженную спичку, и аммиак загорается и горит зеленоватым пламенем:
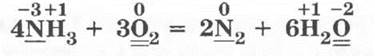
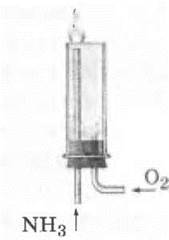
Рис. 29. Сжигание аммиака в кислороде
Уравнение реакции составляют или с помощью дробных коэффициентов (любимый способ слабых учащихся):
![]()
и далее
![]()
или же с помощью электронного баланса:
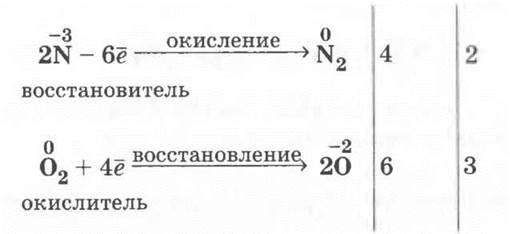
2. У учителей вызывает затруднение демонстрация каталитического (на платине) окисления аммиака. Оказывается, зажигалка для газовых плит, которая работает от двух батареек «Марс» или «Энерджайзер», содержит спираль, которая изготовлена из сплава на основе платины.
Каталитическое окисление аммиака проводится так. В колбу с кислородом приливается 7—10 капель концентрированного раствора аммиака, вводится и включается зажигалка. Происходят реакции:
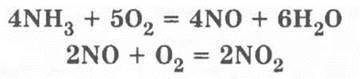
Если аммиак находится в избытке, то идет еще одна реакция:
![]()
Именно поэтому после включения зажигалки появляется белый дым, который может быть желтоватым из-за примеси оксида азота (IV).
Чтобы доказать, что аммиак окислился, в колбу приливают каплю смеси иодида калия с крахмалом, которая синеет.
Первую (ее также можно уравнять с помощью дробных коэффициентов) и вторую записи реакций уравнивают методом электронного баланса. Для экономии времени на уроке можно предложить учащимся проделать это дома.
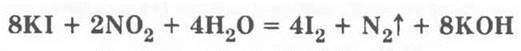
III. Получение, собирание и распознавание аммиака
В лаборатории может быть рассмотрено на уроке как закрепление и обобщение уже полученных сведений.
Получение — взаимодействием щелочи и солей аммония при нагревании:
![]()
Собирание — в перевернутый кверху дном сосуд (почему?). Распознавание — тремя способами:
• по запаху;
• по посинению влажной красной лакмусовой бумажки (почему?);
• по появлению белого дыма от поднесенной стеклянной палочки, смоченной НСl (почему?).
В промышленности аммиак получают синтезом:
![]()
(еще раз дается характеристика реакции и рассматривается смещение равновесия вправо).
IV. Применение аммиака
Эта часть урока дается в виде обобщения по классической связке «свойства — применение».
1. В холодильных установках (почему?).
2. В медицине (что и почему?).
3. Для производства азотной кислоты, солей аммония (почему?).
4. Как удобрения — жидкий аммиак и его водные растворы.
Учитель может сообщить интересующимся медициной учащимся некоторые сведения как профориентационную информацию.
Растворы аммиака довольно широко используются в медицине. Разведенный раствор аммиака, издавна называемый нашатырным спиртом, дают нюхать при обморочных состояниях и алкогольном опьянении; при этом происходит рефлекторное возбуждение сердечной деятельности и центра дыхания. При тяжелом алкогольном отравлении практикуют прием внутрь слабых растворов аммиака (3 капли на полстакана воды).
Более слабые растворы аммиака дают отхаркивающий эффект (нашатырно-анисовые капли).
Местнораздражающее действие аммиака используется для приготовления препаратов, применяемых как отвлекающие средства (при артритах, невралгиях и т. п.).
Хлористый аммоний — белый кристаллический порошок. Слегка гигроскопичен. Имеет солоноватый вкус, хорошо растворим в воде. Применяется в качестве диуретического и отхаркивающего средства.